> Περίληψη
Η Εντεροπάθεια που συνοδεύεται από Απώλεια Πρωτεϊνών (ΕΑΠ) προκαλείται από ποικίλα αίτια και εκδηλώνεται ως σύνδρομο πλημμελούς απορρόφησης. Στην παρούσα μελέτη περιγράφονται δύο περιστατικά σκύλων με ΕΑΠ, λόγω εωσινοφιλικής, λεμφο – πλασμοκυτταρικής εντερίτιδας και λεμφαγγειεκτασίας. Τα ευρήματα από την λήψη του ιστορικού και την κλινική εξέταση ήταν χρόνια διαλείπουσα διάρροια, απώλεια σωματικού βάρους, υποδόρια οιδήματα και ασκίτης. Από τις βιοχημικές εξετάσεις διαπιστώθηκε υπολευκωματιναιμία και υποπρωτεϊναιμία. Στα ζώα διενεργήθηκε ερευνητική λαπαροτομή με σκοπό τη λήψη πολλαπλών ιστοτεμαχίων από το λεπτό έντερο. Οι σκύλοι έλαβαν αιτιολογική θεραπεία για την αντιμετώπιση του πρωτογενούς αιτίου. Η ανταπόκριση στη θεραπεία ήταν ικανοποιητική παρά τις επιπλοκές της λόγω της μακροχρόνιας χορήγησης φαρμάκων. Τα συγκεκριμένα περιστατικά παρουσιάζουν ιδιαίτερο ενδιαφέρον λόγω του σχετικά μεγάλου χρόνου επιβίωσης και της επαρκούς κλινικής ανταπόκρισης μετά την έναρξη της θεραπείας, παρά τη δυσμενή πρόγνωση που συνήθως αναφέρεται για αυτά στη βιβλιογραφία.
> Εισαγωγή
Η απώλεια πρωτεϊνών μπορεί να προκύψει από ποικίλες παθολογικές καταστάσεις με κυριότερες την χρόνια εντεροπάθεια, τη νεφροπάθεια (σπειραματοπάθεια) και την ηπατική ανεπάρκεια. Η ΕΑΠ αναφέρεται ως ένα σύνδρομο στο οποίο συμπεριλαμβάνεται κάθε νόσημα ή παθολογική κατάσταση του εντέρου που προκαλεί απώλεια πρωτεϊνών μέσω του εντερικού αυλού σε βαθμό μεγαλύτερο του φυσιολογικού.1
Οι χρόνιες εντεροπάθειες αποτελούν τη σημαντικότερη αιτία χρόνιας απώλειας πρωτεϊνών και εκδηλώνονται ως σύνδρομο πλημμελούς πέψης-απορρόφησης.2 Η Εξωκρινής Παγκρεατική Ανεπάρκεια (ΕΠΑ) που μπορεί να οδηγήσει δευτερογενώς σε Βακτηριδιακή Υπερανάπτυξη στο Λεπτό Έντερο (ΒΥΛΕ) ή σε διήθηση του εντερικού βλεννογόνου από λεμφοκύτταρα και πλασμοκύτταρα, έχει ως απόρροια την εγκατάσταση του συνδρόμου πλημμελούς πέψης αρχικά και πλημμελούς απορρόφησης στη συνέχεια. Επίσης, η Ιδιοπαθής Φλεγμονώδης Νόσος του Λεπτού Εντέρου (ΙΦΝΕ), η διάρροια που ανταποκρίνεται στα αντιβιοτικά, οι χρόνιες παρασιτώσεις (Giardia spp., Isospora spp, Cryptosporidium spp., Histoplasma spp.), οι εντεροπάθειες ορισμένων φυλών (Basenjis, Shar Peis, German shepherd), η ατροφία λαχνών, τα διάχυτα νεοπλάσματα του λεπτού εντέρου (λέμφωμα κ.ά.), το σύνδρομο βραχέως εντέρου, η διαταραχή των ενζύμων της ψυκτροειδούς παρυφής των λαχνών και η λεμφαγγειεκτασία (πρωτογενής και δευτερογενής) οδηγούν σε σύνδρομο πλημμελούς απορρόφησης.2
Το σύνδρομο πλημμελούς απορρόφησης εμφανίζεται συνήθως με χρόνιες διάρροιες και σημαντική απώλεια βάρους με χαρακτηριστικό εργαστηριακό εύρημα την υπολευκωματιναιμία–υποπρωτειναιμία.3 Εφόσον αποκλειστούν τα συχνότερα αίτια που προκαλούν χρόνια εντεροπάθεια, στη διαφορική διάγνωση παραμένει η ΙΦΝΕ και η λεμφαγγειεκτασία. Η λεμφο - πλασμοκυτταρική εντερίτιδα αποτελεί τη συχνότερη αιτία εκδήλωσης της ΙΦΝΕ στο σκύλο, η αιτιοπαθογένεια της οποίας παραμένει αδιευκρίνιστη αν και θεωρείται πιθανότερη η ενεργοποίηση των ανοσολογικών μηχανισμών λόγω της διαταραχής της κυτταρικής ανοσορύθμισης στο έντερο.2 Η εωσινοφιλική εντερίτιδα, αν και εμφανίζεται συχνότερα στις γάτες, μπορεί να αποτελέσει αίτιο της ΙΦΝΕ και στον σκύλο. Όσον αφορά τη λεμφαγγειεκτασία αυτή μπορεί να είναι συγγενούς ή επίκτητης (λεμφο - πλασμοκυτταρική εντερίτιδα, εωσινοφιλική εντερίτιδα) αιτιολογίας και χαρακτηρίζεται από στάση της λέμφου στα λεμφικά τριχοειδή του εντερικού υποβλεννογόνιου χιτώνα και των λαχνών.1
Στη λεμφαγγειεκτασία παρατηρείται διάταση των τριχοειδών εντερικών λεμφαγγείων και συσσώρευση λέμφου σε αυτά με αποτέλεσμα την στάση του χυλού και υπέρταση μέσα στον αυλό τους η οποία και επεκτείνεται στα λεμφαγγεία του μεσεντερίου.1-2 Έτσι, η λέμφος διαφεύγει στον εντερικό αυλό με τον μηχανισμό της ρήξης, λόγω της αυξημένης πίεσης στα λεμφικά τριχοειδή και με τον μηχανισμό της εξαγγείωσης, προκαλώντας απώλεια των συστατικών του χυλού, στα οποία περιλαμβάνονται οι πρωτεΐνες, τα λεμφοκύτταρα και τα λιπίδια (χυλομικρά), με αποτέλεσμα να προκαλείται σοβαρή υποπρωτεϊναιμία, υπολευκωματιναιμία και λεμφοπενία.3-4 Ένα μέρος των πρωτεϊνών αυτών που απελευθερώνονται στον αυλό του εντέρου, επαναπορροφούνται από το έντερο. Ωστόσο, το μεγαλύτερο μέρος αποβάλλεται μέσω των κοπράνων.1,4
Η μελέτη αυτή περιγράφει δύο περιστατικά σκύλων με ΕΑΠ εστιάζοντας στη διαγνωστική προσέγγιση και στη θεραπευτική αντιμετώπιση.
> Ενδιαφέρουσα περίπτωση 1
Σκύλος ημίαιμος, 6,5 ετών, θηλυκός, στειρωμένος, 13,4 kg, προσκομίστηκε στην Κλινική Ζώων Συντροφιάς (ΚΖΣ) του ΑΠΘ εξαιτίας επιλεκτικής όρεξης ή και ανορεξίας και χρόνιων διαλειπουσών διαρροιών. Ο σκύλος ζούσε εντός σπιτιού και ήταν ελλιπώς αποπαρασιτωμένος και εμβολιασμένος. Σύμφωνα με το ιστορικό από τον Ιούλιο του 2015 εμφάνισε υδαρή κόπρανα καφέ χρωματισμού και ήπια διόγκωση της κοιλίας. Προσκομίστηκε σε ιδιώτη κτηνίατρο από τον οποίο χορηγήθηκε κλινική δίαιτα υποστήριξης του πεπτικού (Hill’s Prescription Diet Canine i/d®, Hill’s Pet Nutrition, Αθήνα, Ελλάδα) και μετρονιδαζόλη σε άγνωστη δόση για 1 μήνα. Με την αγωγή αυτή το ζώο άλλοτε έκανε φυσιολογικά κόπρανα και άλλοτε υδαρή. Μετά από ένα μήνα το ζώο εμφάνισε έντονη διόγκωση κοιλίας και προσκομίστηκε σε άλλη κτηνιατρική κλινική. Στη φάση αυτή ο σκύλος είχε μειωμένες λευκωματίνες ορού και ασκίτη. Η συμπτωματική αγωγή που του χορηγήθηκε (διουρητικό, άγνωστο σκεύασμα και δόση) βελτίωσε την κλινική εικόνα του ζώου. Μετά την πάροδο ενός μήνα ο ασκίτης επανεμφανίστηκε και το ζώο προσκομίστηκε σε άλλο ιδιώτη κτηνίατρο ο οποίος σύστησε να δίνεται μουρουνέλαιο 3 φορές / εβδομάδα. Ωστόσο, τα κόπρανα του ζώου συνέχισαν να είναι πολτώδη χωρίς όμως να υπάρχουν επιπτώσεις στη διάθεση και στην όρεξή του. Τρεις εβδομάδες πριν την προσκόμισή του στην ΚΖΣ ο σκύλος εμφάνιζε ασκίτη, κακή θρεπτική κατάσταση και διαρροϊκές κενώσεις.
Κατά την κλινική εξέταση του ζώου, παρατηρήθηκαν κακή θρεπτική κατάσταση (BCS 1,5/5), ασκίτης και διαρροϊκά κόπρανα με όξινη οσμή. Με βάση την κλίμακα CIBDAI (canine inflammatory bowel disease activity index) η εντεροπάθεια χαρακτηρίστηκε ως πολύ σοβαρή (CIBDAI: 9) Η γενική εξέταση αίματος (ΓΕΑ) έδειξε ουδετεροφιλία (12.200/μl, Φ.Τ.: 3.000-8.000/μl). Από τις βιοχημικές εξετάσεις αίματος βρέθηκαν αυξημένη δραστηριότητα ALP (267 U/L, Φ.Τ: 32-149 U/L) και μειωμένη συγκέντρωση λευκωματινών (1,5 g/dL, Φ.Τ: 2,9-4,0 g/dL). Τέλος μετρήθηκαν στον ορό του αίματος η συγκέντρωση της βιταμίνης Β12 και του φολικού οξέος, οι οποίες κυμαίνονταν εντός των φυσιολογικών ορίων. Ακτινολογικά δεν βρέθηκε κάτι παθολογικό ενώ στο υπερηχογράφημα κοιλίας διαπιστώθηκε ασκίτης και το πάχος του τοιχώματος των εντερικών ελίκων ήταν στα ανώτερα φυσιολογικά επίπεδα. Σύμφωνα με την κυτταρολογική εξέταση, το ασκιτικό υγρό είχε τα χαρακτηριστικά του διιδρώματος.
Κατά τη διήμερη νοσηλεία του ζώου πραγματοποιήθηκαν αφαίρεση 200 ml ασκιτικού υγρού, αγωγή με φουροσεμίδη (1 mg/kg SID, per os) (Lasix® 40 mg tab, Sanofi-Αventis A.E.B.E., Αθήνα, Ελλάδα) και σπειρονολακτόνη (1 mg/kg BID, per os) (ALDACTONE® 25 mg tab, PFIZER HELLAS A.E., Αθήνα, Ελλάδα) ενδοφλέβια χορήγηση ετερόλογων λευκωματινών (HUMAN ALBUMIN® 200 g/l sol inf, Baxter Hellas Ε.Π.Ε., Αθήνα, Ελλάδα), παρακολούθηση για την πιθανότητα εμφάνισης αναφυλακτικής αντίδρασης μετά τη χορήγηση και διατροφή με ειδική δίαιτα για ηπατοπαθή ζώα. Μετά την αποκατάσταση της συγκέντρωσης των λευκωματινών στα κατώτερα αποδεκτά όρια, συστήθηκε περαιτέρω διερεύνηση και πάρθηκε απόφαση για την διενέργεια ερευνητικής λαπαροτομής με σκοπό τη λήψη ιστοτεμαχίων από το έντερο και το ήπαρ.
Η αιτιολογική διάγνωση με βάση τα αποτελέσματα της ιστοπαθολογικής εξετάσης των ιστοτεμαχίων ήταν έντονου βαθμού λεμφοκυτταρική – πλασμοκυτταρική και εωσινοφιλική εντερίτιδα, εντερική λεμφαγγειεκτασία και κενοτοπιώδη εκφύλιση του ήπατος.
Στο ζώο δόθηκε αγωγή, μετά τη μετεγχειρητική νοσηλεία του, που περιελάβανε πρεδνιζολόνη σε ανοσοκατασταλτική δόση (2 mg/kg SID, per os) (PREZOLON® 5 mg tab, TAKEDA ΕΛΛΑΣ Α.Ε., Αθήνα, Ελλάδα), γαστροπροστασία με ρανιτιδίνη (2 mg/kg BID, per os) (EPADOREN® 75mg/5ml syr, DEMO A.B.E.E., Αθήνα, Ελλάδα) και σουκραλφάτη στις συνήθεις δόσεις (1 ml/6kg BID, per os) (PEPTONORM® 1000 mg/5ml oral susp, Uni-Pharma Α.Ε., Αθήνα, Ελλάδα), συμπλήρωμα διατροφής με βιταμίνες του συμπλέγματος B (0,2 mg/ζώο SID, per os) (NEUROBION® 100+200+0,2 mg tab, Merck A.E., Αθήνα, Ελλάδα) ουρσοδεοξυχολικό οξύ (15 mg/ kg SID, per os) (URSOFALK® 250 mg cap, Galenica A.Ε., Αθήνα, Ελλάδα), τριγλυκερίδια μέσης αλύσου MCT oil (2 mg/kg SID, per os) και κλινική δίαιτα με μειωμένη περιεκτικότητα σε λίπος (Hill’s Prescription Diet Canine i/d®, Hill’s Pet Nutrition, Αθήνα, Ελλάδα).
Μετά την πάροδο ενός έτους η κλινική εικόνα του ζώου παραμένει σταθερά καλή.
> Ενδιαφέρουσα περίπτωση 2
Σκύλος 4 ετών, αρσενικός, ακέραιος, φυλής Rottweiler, 41,3 kg, πλήρως εμβολιασμένος, ελλιπώς αποπαρασιτωμένος, που ζει μέσα στο σπίτι, προσκομίστηκε εξαιτίας χρόνιων, από εξαμήνου, διαλειπουσών διαρροιών. Σύμφωνα με το ιστορικό, οι κενώσεις είχαν υδαρή σύσταση, ήταν δύσοσμες, αυξημένου όγκου, δεν συνοδεύονταν από τεινεσμούς και είχαν ξεκινήσει ένα χρόνο πριν την προσκόμισή του. Όλο αυτό το διάστημα, το ζώο έλαβε συμπτωματική αγωγή για την αντιμετώπιση αρχικά της Giardia spp., έπειτα για κοκκίδια καθώς και για ΙΦΝΕ και ΕΠΑ σύμφωνα με τις οδηγίες ιδιωτών κτηνιάτρων, χωρίς να είναι γνωστές οι δραστικές ουσίες και τα δοσολογικά σχήματα που χρησιμοποιήθηκαν. Παρ’ όλα αυτά, οι διάρροιες συνεχίστηκαν και το ζώο παρουσίασε απώλεια βάρους, μείωση όρεξης, πολυουρία/πολυδιψία (PU/PD) και για το λόγο αυτό δόθηκε κλινική δίαιτα (Hill’s Prescription Diet Canine i/d®, Hill’s Pet Nutrition, Αθήνα, Ελλάδα) για χρονικό διάστημα 40 ημερών πριν την προσκόμισή του.
 Κατά την κλινική εξέταση του ζώου, παρατηρήθηκε μέτρια θρεπτική κατάσταση (BCS 2/5), αφυδάτωση 7% και διατεταμένα κοιλιακά τοιχώματα κατά την ψηλάφηση. Οι υπόλοιπες παράμετροι της κλινικής εξέτασης ήταν κατά φύση. Με βάση την κλίμακα CIBDAI η εντεροπάθεια χαρακτηρίστηκε ως πολύ σοβαρή (CIBDAI: 9) Η ΓΕΑ ήταν φυσιολογική, ενώ στη βιοχημική εξέταση του ορού του αίματος παρατηρήθηκε αυξημένη δραστηριότητα της ALP (307 U/L, ΦΤ: 32-149 U/L), και μειωμένη συγκέντρωση λευκωματινών (1,8 gr/dL, ΦΤ: 2,9-4 gr/dL). H ανάλυση του ούρου έδειξε μειωμένο Ε.Β. ούρου (1026, ΦΤ: >1030) και παρουσία χολοχρωστικών (++). Επίσης, μετρήθηκε η συγκέντρωση της βιταμίνης Β12 στον ορό και βρέθηκε μειωμένη (180 pg/ml, ΦΤ: >350 pg/ml). Απεικονιστικά (ακτινογραφία και υπερηχογράφημα κοιλίας) παρατηρήθηκε ασκίτης. Κατά την εξέταση του ασκιτικού υγρού διαπιστώθηκε ότι αυτό ήταν διίδρωμα. Κατά την γαστροσκόπηση (OLYMPUS, XP20) δεν παρατηρήθηκαν αξιόλογα μακροσκοπικάευρήματα στον οισοφάγο και στο στόμαχο. Η προσπέλαση προς το λεπτό έντερο δεν κατέστη δυνατή, λόγω αδυναμίας διάβασης του πυλωρικού στομίου.
Κατά την κλινική εξέταση του ζώου, παρατηρήθηκε μέτρια θρεπτική κατάσταση (BCS 2/5), αφυδάτωση 7% και διατεταμένα κοιλιακά τοιχώματα κατά την ψηλάφηση. Οι υπόλοιπες παράμετροι της κλινικής εξέτασης ήταν κατά φύση. Με βάση την κλίμακα CIBDAI η εντεροπάθεια χαρακτηρίστηκε ως πολύ σοβαρή (CIBDAI: 9) Η ΓΕΑ ήταν φυσιολογική, ενώ στη βιοχημική εξέταση του ορού του αίματος παρατηρήθηκε αυξημένη δραστηριότητα της ALP (307 U/L, ΦΤ: 32-149 U/L), και μειωμένη συγκέντρωση λευκωματινών (1,8 gr/dL, ΦΤ: 2,9-4 gr/dL). H ανάλυση του ούρου έδειξε μειωμένο Ε.Β. ούρου (1026, ΦΤ: >1030) και παρουσία χολοχρωστικών (++). Επίσης, μετρήθηκε η συγκέντρωση της βιταμίνης Β12 στον ορό και βρέθηκε μειωμένη (180 pg/ml, ΦΤ: >350 pg/ml). Απεικονιστικά (ακτινογραφία και υπερηχογράφημα κοιλίας) παρατηρήθηκε ασκίτης. Κατά την εξέταση του ασκιτικού υγρού διαπιστώθηκε ότι αυτό ήταν διίδρωμα. Κατά την γαστροσκόπηση (OLYMPUS, XP20) δεν παρατηρήθηκαν αξιόλογα μακροσκοπικάευρήματα στον οισοφάγο και στο στόμαχο. Η προσπέλαση προς το λεπτό έντερο δεν κατέστη δυνατή, λόγω αδυναμίας διάβασης του πυλωρικού στομίου.
Βάσει των ευρημάτων και του ιστορικού, διαγνώστηκε χρόνια ΕΑΠ και ασκίτης. Χορηγήθηκε πρεδνιζολόνη (1,5 mg/kg BID per os), ομεπραζόλη (0,25 mg/kg SID per os) (LOSEC® 20 mg cap, Astra Zeneca A.E., Αθήνα, Ελλάδα), MCT oil και ηλεκτρολύτες-πρεβιοτικά – προσροφητικοί παράγοντες (Diarsanyl Plus® 10ml/24ml, Ceva, Αθήνα, Ελλάδα), σε συνδυασμό με κλινική δίαιτα υποστήριξης του πεπτικού (Hill’s Prescription Diet Canine i/d®), ενώ για τον ασκίτη δόθηκε φουροσεμίδη (3 mg/kg BID per os).
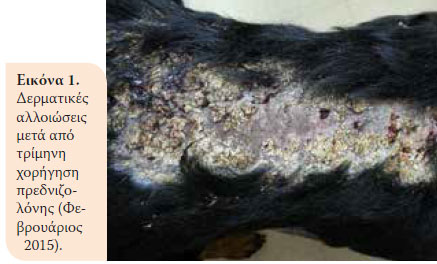
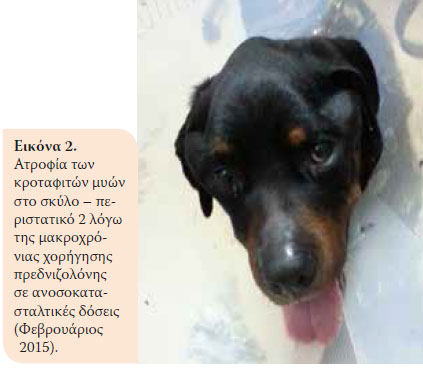 Κατά την επανεξέταση, ένα μήνα μετά, το ζώο παρουσίαζε κλινική βελτίωση. Όμως δύο μήνες αργότερα παρουσιάστηκε αίμα ζωηρού χρώματος στα κόπρανα και μείωση σωματικού βάρους (36,5 kg). Έτσι, στη δεύτερη επανεξέταση βρέθηκε κακή θρεπτική κατάσταση και αυξημένη δραστηριότητα της ALT 124U/L (ΦΤ:18- 62U/L), της ALP 1100U/L (Φ.Τ.: 32-149U/L) και Ε.Β. ούρου 1015 (Φ.Τ.: >1030). Συστήθηκε μείωση της δόσης της πρεδνιζολόνης (0,75 mg/kg BID per os) και προσθήκη αζαθειοπρίνης (1,8 mg/kg BID per os) (AZATHIOPRINE® 50mg tab, Chemipharm Ντετσαβές Ε.Ε., Αθήνα, Ελλάδα) στο θεραπευτικό σχήμα. Έπειτα από ένα μήνα, το ζώο παρουσίασε διαρροϊκά έως πολτώδη κόπρανα με κηλίδες αίματος και επαναπροσκομίστηκε. Διαπιστώθηκε υπολευκωματιναιμία (2,2 g/dL, Φ.Τ.: 2,9-4 g/dL). Ένα μήνα μετά, η κατάσταση του ζώου επιδεινώθηκε. Κατά την κλινική εξέταση παρουσίασε πυρετό, δερματικές αλλοιώσεις (Eικόνα 1), μυϊκή ατροφία (Eικόνα 2), απώλεια σωματικού βάρους, ενώ τα ευρήματα της βιοχημικής εξέτασης έδειξαν αύξηση της δραστηριότητας της ALT (123 U/L, Φ.Τ.:18-62U/L) και της ALP (1286 U/L, Φ.Τ.: 32-149U/L) και οι λευκωματίνες βρίσκονταν στα κατώτερα αποδεκτά όρια (Φ.Τ.:2,9-4 g/dL). Έπειτα από 10 μέρες, το ζώο νοσηλεύτηκε με σκοπό τη διενέργεια βιοψίας εντέρου μετά από λαπαροτομή. Κατά τον προεγχειρητικό έλεγχο, διαπιστώθηκε μειωμένος αιματοκρίτης (32,5%, Φ.Τ.:37,1-55%) και λευκωματίνες (2,4 g/dl, Φ.Τ.:2,9-4 g/dL). Για τους παραπάνω λόγους έγινε μετάγγιση αίματος με αποτέλεσμα την αύξηση του αιματοκρίτη στο 36,4% (Φ.Τ.:37,1-55%) και έτσι έγινε εφικτή και η πραγματοποίηση της βιοψίας του εντέρου. Ο μετεγχειρητικός εργαστηριακός έλεγχος έδειξε μειωμένες λευκωματίνες και ολικά στερεά και αποφασίστηκε η χορήγηση ετερόλογων λευκωματικών (HUMAN ALBUMIN® 200 g/l sol inf, Baxter Hellas Ε.Π.Ε., Αθήνα, Ελλάδα). Το ζώο έμεινε υπό παρακολούθηση για μία ημέρα για την περίπτωση εμφάνισης αναφυλακτικής αντίδρασης εξαιτίας της χορήγησης λευκωματινών και έπειτα δόθηκε εξιτήριο με σύσταση για συνέχιση της αγωγής με βάση την πρεδνιζολόνη και την αζαθειοπρίνη.
Κατά την επανεξέταση, ένα μήνα μετά, το ζώο παρουσίαζε κλινική βελτίωση. Όμως δύο μήνες αργότερα παρουσιάστηκε αίμα ζωηρού χρώματος στα κόπρανα και μείωση σωματικού βάρους (36,5 kg). Έτσι, στη δεύτερη επανεξέταση βρέθηκε κακή θρεπτική κατάσταση και αυξημένη δραστηριότητα της ALT 124U/L (ΦΤ:18- 62U/L), της ALP 1100U/L (Φ.Τ.: 32-149U/L) και Ε.Β. ούρου 1015 (Φ.Τ.: >1030). Συστήθηκε μείωση της δόσης της πρεδνιζολόνης (0,75 mg/kg BID per os) και προσθήκη αζαθειοπρίνης (1,8 mg/kg BID per os) (AZATHIOPRINE® 50mg tab, Chemipharm Ντετσαβές Ε.Ε., Αθήνα, Ελλάδα) στο θεραπευτικό σχήμα. Έπειτα από ένα μήνα, το ζώο παρουσίασε διαρροϊκά έως πολτώδη κόπρανα με κηλίδες αίματος και επαναπροσκομίστηκε. Διαπιστώθηκε υπολευκωματιναιμία (2,2 g/dL, Φ.Τ.: 2,9-4 g/dL). Ένα μήνα μετά, η κατάσταση του ζώου επιδεινώθηκε. Κατά την κλινική εξέταση παρουσίασε πυρετό, δερματικές αλλοιώσεις (Eικόνα 1), μυϊκή ατροφία (Eικόνα 2), απώλεια σωματικού βάρους, ενώ τα ευρήματα της βιοχημικής εξέτασης έδειξαν αύξηση της δραστηριότητας της ALT (123 U/L, Φ.Τ.:18-62U/L) και της ALP (1286 U/L, Φ.Τ.: 32-149U/L) και οι λευκωματίνες βρίσκονταν στα κατώτερα αποδεκτά όρια (Φ.Τ.:2,9-4 g/dL). Έπειτα από 10 μέρες, το ζώο νοσηλεύτηκε με σκοπό τη διενέργεια βιοψίας εντέρου μετά από λαπαροτομή. Κατά τον προεγχειρητικό έλεγχο, διαπιστώθηκε μειωμένος αιματοκρίτης (32,5%, Φ.Τ.:37,1-55%) και λευκωματίνες (2,4 g/dl, Φ.Τ.:2,9-4 g/dL). Για τους παραπάνω λόγους έγινε μετάγγιση αίματος με αποτέλεσμα την αύξηση του αιματοκρίτη στο 36,4% (Φ.Τ.:37,1-55%) και έτσι έγινε εφικτή και η πραγματοποίηση της βιοψίας του εντέρου. Ο μετεγχειρητικός εργαστηριακός έλεγχος έδειξε μειωμένες λευκωματίνες και ολικά στερεά και αποφασίστηκε η χορήγηση ετερόλογων λευκωματικών (HUMAN ALBUMIN® 200 g/l sol inf, Baxter Hellas Ε.Π.Ε., Αθήνα, Ελλάδα). Το ζώο έμεινε υπό παρακολούθηση για μία ημέρα για την περίπτωση εμφάνισης αναφυλακτικής αντίδρασης εξαιτίας της χορήγησης λευκωματινών και έπειτα δόθηκε εξιτήριο με σύσταση για συνέχιση της αγωγής με βάση την πρεδνιζολόνη και την αζαθειοπρίνη.
 Η αιτιολογική διάγνωση σύμφωνα με το αποτέλεσμα της ιστοπαθολογικής εξέτασης ήταν λεμφο-πλασμοκυτταρική εντερίτιδα και δευτερογενής λεμφαγγειεκτασία.
Η αιτιολογική διάγνωση σύμφωνα με το αποτέλεσμα της ιστοπαθολογικής εξέτασης ήταν λεμφο-πλασμοκυτταρική εντερίτιδα και δευτερογενής λεμφαγγειεκτασία.
Ένα μήνα μετά τα αποτελέσματα της ιστοπαθολογικής εξέτασης το ζώο προσκομίστηκε για επαναξέταση. Δεδομένης της θετικής εξέλιξης αποφασίστηκε η μείωση της πρεδνιζολόνης σταδιακά, έως ότου διεκόπει πλήρως. Κατά τις ανά τρίμηνo επανεξετάσεις (συνολικής διάρκειας 18 μηνών) η κλινική και εργαστηριακή εικόνα του ζώου είναι σταθερή με αποκατάσταση των κενώσεων, εξαφάνιση του ασκίτη και βελτίωση του σωματικού βάρους του (Εικόνα 3).
> Συζήτηση
Η παρούσα μελέτη στοχεύει στην κοινοποίηση της διαγνωστικής προσέγγισης, των θεραπευτικών επιλογών και της μακροχρόνιας πρόγνωσης σε σκύλους με ΕΑΠ. Η συγκεκριμένη νοσολογική κατάσταση (ΕΑΠ) εμφανίζεται με φθίνουσα σειρά συχνότητας σε φυλές σκύλων όπως Soft Coated Wheaten Terrier, Shar-pei, Yorkshire, Rottweiler, Basenji, Lundehund και English Springer Spaniel.5-7 Τα περισσότερα περιστατικά με ΕΑΠ σχετίζονται με ΙΦΝΕ, λέμφωμα ή λεμφαγγειεκτασία.8 Στα ζώα της παρούσας μελέτης διαγνώστηκε με βάση τα ιστοπαθολογικά ευρήματα ΙΦΝΕ (λεμφο - πλασμοκυτταρική, εωσινοφιλική εντερίτιδα) και δευτερογενώς λεμφαγγειεκτασία.
Αίτιο προσκόμισης του ζώων ήταν οι χρόνιες διαλείπουσες διάρροιες από το λεπτό έντερο, η απώλεια Σ.Β. και ο ασκίτης. Γενικά, τα ζώα με ΕΑΠ παρουσιάζουν συμπτώματα κοινά με τις περισσότερες παθήσεις του γαστρεντερικού σωλήνα. Τα πιο συχνά είναι η επίμονη ή διαλείπουσα διάρροια από το λεπτό έντερο, η μείωση του ΣΒ, ο έμετος και ο ασκίτης, ο υδροθώρακας, το υποδόριο οίδημα λόγω της υποπρωτειναιμίας.1,2
Η διάγνωση τέτοιων περιστατικών αποτελεί πρόκληση για τον κλινικό κτηνίατρο. Όπως προκύπτει από το ιστορικό και τα αποτελέσματα της κλινικής εξέτασης διαμορφώνεται ένας μακροσκελής κατάλογος διαφορικής διάγνωσης γαστρεντερικών και μη νοσημάτων. Έτσι, προκύπτει η ανάγκη διενέργειας εργαστηριακών εξετάσεων που περιλαμβάνουν τη ΓΕΑ, την ανάλυση του πλήρους βιοχημικού προφίλ και την ανάλυση του ούρου.6 Τα βασικά εργαστηριακά ευρήματα που κατευθύνουν τον κλινικό κτηνίατρο προς τη διάγνωση της ΕΑΠ είναι η υπολευκωματιναιμία, η υποπρωτεϊναιμία και η υποχολοστερολαιμία.2 Στα συγκεκριμένα περιστατικά οι αρχικές εργαστηριακές εξετάσεις δεν έδωσαν αξιόλογα διαγνωστικά ευρήματα. Έτσι, εκτιμήθηκαν επιπλέον βιοχημικές παράμετροι, όπως η συγκέντρωση της βιταμίνης Β12 στον ορό. Γενικά, ευρήματα όπως η υπασβεστιαιμία, η υπομαγνησιαιμία και η λεμφοπενία ενισχύουν την υποψία διάγνωσης ΕΑΠ γι’ αυτό καλό θα είναι να προσμετρούνται σε υποψία της.6,9,10 Συγκεκριμένα, η λεμφοπενία σχετίζεται τις περισσότερες φορές με ΕΑΠ λόγω λεμφαγγειεκτασίας6 αν και στα περιστατικά που αναλύονται δεν παρατηρήθηκε κάτι τέτοιο. Επίσης, σε περίπλοκα περιστατικά όπως τα παραπάνω, η μέτρηση των χολικών οξέων μπορεί να κατευθύνει προς την αιτία της απώλειας των πρωτεϊνών. Αυξημένη συγκέντρωση χολικών οξέων σε συνδυασμό με υποχολοστερολαιμία και μειωμένο BUN δεν αποκλείει την ΕΑΠ λόγω του ότι τα νοσήματα του γαστρεντερικού μπορούν να προκαλέσουν αύξηση της συγκέντρωσης των χολικών οξέων του ορού.1,6 Σε τέτοιες περιπτώσεις, η διαφοροποίηση πρωτογενούς νόσου του εντέρου από ηπατοπάθεια μπορεί να γίνει μόνο με ιστοπαθολογική εξέταση ή μέτρηση της συγκέντρωσης του αναστολέα της α1-πρωτεϊνάσης (α1-PI) στα κόπρανα των ύποπτων σκύλων. Η α1-PI είναι ένας φυσικός αναστολέας των πρωτεασών (πχ. θρυψίνης) που έχει σχεδόν το ίδιο μοριακό μέγεθος με την λευκωματίνη. Οποιαδήποτε στιγμή υπάρχει απώλεια λευκωματινών από τον γαστρεντερικό σωλήνα, αυτή συνοδεύεται από ταυτόχρονη απώλεια της α1-PI, η οποία βρίσκεται αυτούσια στα κόπρανα του ασθενούς σκύλου γι’ αυτό και αποτελεί βασικό δείκτη διάγνωσης ΕΑΠ.6,11 Δυστυχώς, λόγω τεχνικών δυσκολιών δεν έγινε μέτρηση της α1-PI στα κόπρανα των συγκεκριμένων περιστατικών. Έχει αναφερθεί περίπτωση σκύλου φυλής Beagle στον οποίο η διάγνωση της ΕΑΠ έγινε με βάση την α1-PI λόγω άρνησης των ιδιοκτητών για διενέργεια βιοψίας και το ζώο ανταποκρίθηκε στη θεραπεία επιτυχώς.12
Όσον αφορά τη διαγνωστική απεικόνιση, η ακτινολογική εξέταση της κοιλίας δεν αποκαλύπτει ουσιαστικά ευρήματα σε ζώα με ΕΑΠ. Από την άλλη, το υπερηχοτομογράφημα είναι απαραίτητο διότι μπορεί να υποδείξει τη μέθοδο βιοψίας του λεπτού εντέρου (χειρουργική ή ενδοσκοπική). Κατά την υπερηχοτομογραφία, είναι δυνατόν να φανούν υπερηχογενείς περιοχές του βλεννογόνου του λεπτού εντέρου με έντονη αυλάκωση, χαρακτηριστικό της λεμφαγγειεκτασίας καθώς και μια γενικευμένη πάχυνση του λεπτού εντέρου και διόγκωση των μεσεντέριων λεμφαδένων. Η αναγνώριση εστιακών ή ανομοιόμορφων αλλοιώσεων που δεν είναι προσβάσιμες με το ενδοσκόπιο αποτελούν επαρκή ένδειξη για διενέργεια χειρουργικής βιοψίας.1,10 Υπάρχουν όμως και περιπτώσεις που η συγκεκριμένη εξέταση δεν δίνει κανένα εύρημα από το έντερο, όπως στα εν λόγω περιστατικά. Ωστόσο, ήταν ευδιάκριτη υπερηχοτομογραφικά η ύπαρξη υγρού στην κοιλιακή κοιλότητα και στα δυο ζώα.
Η επιβεβαίωση της διάγνωσης γίνεται με βάση τα ιστοπαθολογικά ευρήματα που προκύπτουν μετά από βιοψία του λεπτού εντέρου. Η λήψη του υλικού βιοψίας μπορεί να γίνει είτε με ενδοσκόπηση είτε με ερευνητική λαπαροτομή.2 Η επιλογή της τεχνικής βιοψίας εξαρτάται από πολλούς παράγοντες κάποιοι από τους οποίους είναι η ύπαρξη εξοπλισμού και η δεξιότητα του κτηνιάτρου όσον αφορά τη διενέργεια της λαπαροτομής ή της ενδοσκόπησης. Αναφορικά με τα πλεονεκτήματα της λαπαροτομής ο κτηνίατρος έχει τη δυνατότητα να παρατηρήσει το λεπτό έντερο σε όλη την έκτασή του και να συλλέξει υλικό για βιοψία και από τα τρία τμήματά του. Αντίθετα, με την ενδοσκόπηση, έχει πρόσβαση στον αυλό του εντέρου και μπορεί να συλλέξει για βιοψία αλλοιωμένες περιοχές μόνο του εντερικού βλεννογόνου. Πλεονέκτημα όμως είναι το γεγονός ότι αποτελεί λιγότερο επεμβατική μέθοδο και γίνεται σε σύντομο χρονικό διάστημα. Ωστόσο, βασικό μειονέκτημα της ενδοσκόπησης είναι η αποτυχία διάβασης του ενδοσκοπίου πέρα της αρχικής μοίρας του δωδεκαδακτύλου.6,10 Στο περιστατικό 2 έγινε προσπάθεια λήψης υλικού για βιοψία με ενδοσκόπιο, όμως ήταν αδύνατη η διάβαση του πυλωρικού στομίου λόγω έντονης σύσπασης του σφικτήρα και μεγάλου βαθμού διάταση του στομάχου. Έπειτα από τρείς μήνες, και ενώ η κατάσταση του ζώου επιδεινωνόταν διενεργήθηκε ερευνητική λαπαροτομή.
Και στα δύο περιστατικά βρέθηκαν χαμηλές λευκωματίνες ορού και αποφασίστηκε η ενδοφλέβια χορήγηση ανθρώπινων λευκωματινών. Η χορήγηση των ανθρώπινων λευκωματινών και στα δυο ζώα έγινε όπως αυτή περιγράφεται στη βιβλιογραφία.13 Γενικά, η χορήγηση ανθρώπινων λευκωματινών πρέπει να επιλέγεται όταν έχουν εξαντληθεί όλοι οι υπόλοιποι τρόποι θεραπείας σε περιστατικά με υπολευκωματιναιμία.14 Αυτό προκύπτει από το γεγονός ότι έχουν παρατηρηθεί πολλές ανεπιθύμητες ενέργειες που μπορεί να αποβούν μοιραίες για τη ζωή των ζώων, όπως πνευμονικό οίδημα, νεφρική ανεπάρκεια και διαταραχές πηκτικότητας, αμέσως μετά τη χορήγηση ή και καθυστερημένα σε διάστημα έως 4-6 εβδομάδες. Άλλες ανεπιθύμητες ενέργειες που μπορεί να παρατηρηθούν είναι η χωλότητα στο άκρο που έγινε χορήγηση, η ληθαργικότητα, οι δερματικές αλλοιώσεις λόγω αγγειίτιδας και ο πυρετός.10,15 Το γεγονός ότι τα ζώα της παρούσας μελέτης δεν εμφάνισαν αναφυλακτική αντίδραση μπορεί να οφείλεται στην καταστολή του ανοσοποιητικού που παρουσίαζαν λόγω χορήγησης σε μακροχρόνια βάση πρεδνιζολόνης. Έχει βρεθεί, ότι τα επίπεδα των αντισωμάτων IgG κατά των ανθρώπινων λευκωματινών που ευθύνονται για την ανοσολογική αντίδραση υπερευαισθησίας τύπου ΙΙΙ, είναι μειωμένα σε σοβαρά άρρωστα ζώα σε σχέση με τα υγιή. Αυτό εικάζεται ότι οφείλεται στην απώλεια των IgG από τον γαστρεντερικό σωλήνα λόγω της υποκείμενης νόσου,14 που στην περίπτωση των συγκεκριμένων περιστατικών είναι η ΕΑΠ.
Η αντιμετώπιση των περιστατικών με ΕΑΠ βασίζεται σε κάποιους βασικούς θεραπευτικούς άξονες. Αρχικά, το ζώο πρέπει να λάβει τα κατάλληλα διαιτητικά μέτρα, τα οποία θα χορηγούνται εφόρου ζωής,2 όπως συμβαίνει και με τους σκύλους της μελέτης μας. Συγκεκριμένα, και στα δυο ζώα χορηγούνται κλινικές δίαιτες του εμπορίου με συγχορήγηση MCT oil (τριγλυκερίδια μέσης αλύσου). Εναλλακτικά, μπορεί να χορηγηθεί τροφή που παρασκευάζεται στο σπίτι, η οποία πρέπει να περιέχει πρωτεΐνες υψηλής βιολογικής αξίας που θα προέρχονται από μία πηγή (πχ. βρασμένο κρέας κοτόπουλου χωρίς το δέρμα), υδατάνθρακες (ιδανική πηγή είναι το λευκό βρασμένο ρύζι), περιορισμένη περιεκτικότητα φυτικών ινών, μικρές ποσότητες λίπους και να εμπλουτίζεται με βιταμίνες, ιχνοστοιχεία, ασβέστιο και φώσφορο. Η μειωμένη περιεκτικότητα λίπους και συγκεκριμένα τριγλυκεριδίων μακράς αλύσου, αποτελεί ακρο- γωνιαίο λίθο της θεραπείας, γιατί μειώνει την απώλεια των πρωτεϊνών από τον αυλό του εντέρου. Όμως, το ζώο πρέπει να καλύψει τις θερμιδικές του ανάγκες, γι’ αυτό πρέπει πάντα να χορηγούνται τριγλυκερίδια μέσης αλύσου παρά τα προβλήματα γευστικότητας που παρουσιάζουν.1,16 Σύμφωνα με μια δημοσίευση, σκύλος με ΕΑΠ λόγω λεμφαγγειεκτασίας, στον οποίο χορηγήθηκε μόνο κλινική δίαιτα είχε ικανοποιητικά κλινικά αποτελέσματα και δεν χρειάστηκε επιπλέον θεραπευτική αγωγή.12 Από την άλλη, μόνη της η κλινική δίαιτα δεν φαίνεται να έχει αποτέλεσμα σε σκύλους με σοβαρή συμπτωματολογία.16 Σε σκύλους που παρουσιάζουν έντονη ανορεξία γίνεται προσπάθεια διέγερσης της όρεξής τους (πχ. χορήγηση κυπροεπτανίδης).2 Σε περίπτωση αποτυχίας αυτής, η διατροφική υποστήριξη του ζώου γίνεται με εντερική διατροφή που συμβάλλει στην επανάκτηση της εντερικής ακεραιότητας.2
Η χορήγηση ανοσοκατασταλτικών φαρμάκων είναι ιδιαίτερα σημαντική για την κλινική βελτίωση των ασθενών ζώων. Αρχικά, συστήνεται η χορήγηση πρεδνιζολόνης σε ανοσοκατασταλτική δόση για χρονικό διάστημα τουλάχιστον 4 εβδομάδων.2 Η συγχορήγηση γαστροπροστατευτικών είναι απαραίτητη όταν η πρεδνιζολόνη δίνεται σε ανοσοκατασταλτικές δόσεις και επί μακρών.2 Σε μια μελέτη, η μείωση της λιποπεριεκτικότητας της τροφής φαίνεται να έχει ως αποτέλεσμα την ανταπόκριση των ζώων στη θεραπεία με μειωμένες δόσεις πρεδνιζολόνης, γεγονός που μειώνει την πιθανότητα εμφάνισης ανεπιθύμητων ενεργειών λόγω της καταβολικής της δράσης.16 Η δόση της πρεδνιζολόνης μειώνεται σταδιακά μετά την κλινική ύφεση των συμπτωμάτων.2 Όταν αυτή χορηγείται επί μακρών μπορεί να επιφέρει ανεπιθύμητες ενέργειες (π.χ. ιατρογενής υπερφλοιοεπινεφριδισμός) και έτσι απαιτείται η συγχορήγηση ενός επιπλέον ανοσοκατασταλτικού φαρμάκου (π.χ. αζαθειοπρίνη) με ταυτόχρονη μείωση της δόσης της πρεδνιζολόνης.2,3 Στο περιστατικό 2, μετά από 3 μήνες θεραπείας με πρεδνιζολόνη και ομεπραζόλη, συγχορηγήθηκε αζαθειοπρίνη και μειώθηκε η δόση της πρώτης λόγω εμφάνισης ανεπιθύμητων ενεργειών. Εναλλακτικά της αζαθειοπρίνης μπορεί να χορηγηθεί ως ανοσοκατασταλτικό η κυκλοφωσφαμίδη, η χλωραμβουκίλη, η μεθοτρεξάτη και η κυκλοσπορίνη.16-17 Σύμφωνα με μια μελέτη, ο συνδυασμός πρεδνιζολόνης-χλωραμβουκίλης φαίνεται να αυξάνει περισσότερο τις λευκωματίνες και το ΣΒ και να επιφέρει ταχύτερη κλινική βελτίωση σε σχέση με τη συνδυαστική χορήγηση πρεδνιζολόνης-αζαθειοπρίνης, ενώ σχετίζεται και με καλύτερη πρόγνωση.18 Όταν κρίνεται επιτακτική η διακοπή της πρεδνιζολόνης, αυτή αντικαθίσταται από την βουδεσονίδη. Ακόμη, σε ζώα με σοβαρή εντερική δυσαπορρόφηση χορηγείται δεξαμεθαζόνη παρεντερικά.2
Η χορήγηση αντιβακτηριδιακών ουσιών κρίνεται απαραίτητη σε ζώα με ΕΑΠ λόγω συνύπαρξης δευτερογενούς ΒΥΕ. Τα αντιβιοτικά που χρησιμοποιούνται στη πράξη είναι η μετρονιδαζόλη και η τυλοζίνη.2
Λόγω της σοβαρής υπολευκωματιναιμίας στα ζώα με ΕΑΠ εμφανίζεται ασκίτης. Για την αντιμετώπισή του χορηγούνται φουροσεμίδη, σπειρονολακτόνη ή συνδυασμός αυτών.2 Σε έναν σκύλο με ΕΑΠ διαπιστώθηκε υπομαγνησιαιμία και δευτερογενής υποπαραθυρεοειδισμός. Συστήνεται λοιπόν ο υπολογισμός της συγκέντρωσης του μαγνησίου του ορού και αν αυτή είναι μειωμένη πρέπει να αναπληρώνεται.9
Ένας πρώιμος δείκτης της ΕΑΠ είναι η παρουσία περιπυρηνικών αντιουδετεροφιλικών αυτοαντισωμάτων στο κυτταρόπλασμα (pANCAs). Η ορολογική δοκιμή pANCAs ήταν θετική σε ζώα με ΕΑΠ περίπου 2,4 χρόνια πριν την εμφάνιση της υπολευκωματιναιμίας. Δυστυχώς όμως αυτή η εξέταση δεν είναι διαθέσιμη στην καθημερινή κλινική πράξη.11
Η πρόγνωση των ζώων με ΕΑΠ είναι επιφυλακτική έως κακή. Η κλίμακα CIBDAI (canine inflammatory bowel disease activity index) η οποία υπολογίστηκε στα περιστατικά της παρούσας μελέτης, αποτελεί προγνωστικό δείκτη για τα ζώα που εμφανίζουν ΕΑΠ.19-20 Η ανταπόκριση στη θεραπεία δεν είναι προβλέψιμη, και πολλά περιστατικά εμφανίζουν κλινική ύφεση ύστερα από μήνες θεραπείας. Μετά τη βελτίωση της κλινικής κατάστασης μερικοί σκύλοι παραμένουν σε ύφεση για χρόνια, ενώ άλλοι σκύλοι εκδηλώνουν ταχύτατα υποπρωτεϊναιμία ή θρομβοεμβολές. Ακόμη, άλλα ζώα αδυνατούν να ανταποκριθούν στη θεραπεία και στη συνέχεια υποτροπιάζουν. Προοδευτικά και παρά τη θεραπεία, η κατάστασή τους επιδεινώνεται, για να καταλήξουν, μετά από γενικευμένη καχεξία, στο θάνατο.10,16-17
> Βιβλιογραφία
1. Milstein M, Sanford SE. Intestinal lymphangiectasia in a dog. Can Vet J 1977, 18: 127-130.
2. Rallis T. Disease of the small intestine. In: Gastroenterology of Dog and Cat. Rallis T (ed). 2nd edn. University Studio Press: Thessaloniki, 2006, pp. 145-189.
3. Birchard S, Sherding R. Disease of the small and large intestine. In: Saunders Manual of Small Animal Practice. Sherding R, Johnson S (eds). 3rd end. Rotoda: Thessaloniki, 2006, pp. 702-738.
4. Lecoindre P, Gaschen F, Monnet E. Disease of the small intestine. In: Canine and Feline Gastrenterology. Willard M (ed). Les Editions du Point Veterinaire: France, 2010, pp 246-316.
5. Simpson K, Jergens A. Pitfalls and Progress in the Diagnosis and Management of Canine Inflammatory Bowel Disease. Vet Clin North Am Small Anim Pract 2011, 41(2): 381-398.
6. Peterson PB, Willard MD. Protein-losing enteropathies. Vet Clin North Am Small Anim Pract 2003, 33: 1061-1082.
7. Lane I, Miller E, Twedt D. Parenteral nutrition in the management of a dog with lymphocytic-plasmacytic enteritis and severe proteinlosing enteropathy. Can Vet J 1999, 40: 721-724.
8. Allenspach K. Clinical Immunology and Immunopathology of the Canine and Feline Intestine. Vet Clin North Am Small Anim Pract 2011, 41(2): 345-360.
9. Bush W, Kimmel S, Wosar M, Jackson M. Secondary hypoparathyroidism attributed to hypomagnesemia in a dog with protein-losing enteropathy. JAVMA 2001, 219: 1732-1734
10. Dossin O, Lavoue R. Protein-Losing Enteropathies in Dogs. Vet Clin North Am Small Anim Pract 2011, 41(2): 399-418.
11. Berghoff N, Steiner J. Laboratory Tests for the Diagnosis and Management of Chronic Canine and Feline Enteropathies. Vet Clin North Am Small Anim Pract 2011, 41(2): 311-328.
12. Brooks T. Case study in canine intestinal lymphangiectasia. Can Vet J 2005, 46: 1138-1142.
13. Plumb D. Veterinary Drug Handbook. 7th Edition. PharmaVet: Stockholm, 2011, pp. 78-83.
14. Powell C, Thompson L, Murtaugh R. Type III hypersensitivity reaction with immune complex deposition in 2 critically ill dogs administered human serum albumin. J Vet Emerg Crit Care 2013, 23: 598-604.
15. Vigano F, Perissinotto L, Bosco VR.Administration of 5% human serum albumin in critically ill small animal patients with hypoalbuminemia: 418 dogs and 170 cats (1994-2008). J Vet Emerg Crit Care 2010, 20: 237-243.
16. Okanishi H, Yoshioka R, Kagawa Y, Watari T. The Clinical Efficacy of Dietary Fat Restriction in Treatment of Dogs with Intestinal Lymphangiectasia. J Vet Intern Med 2014, 28: 809-817.
17. Yuki M, Sugimoto N, Takahashi K, Otsuka H, Nishii N, Suzuki K, Yamagami T, Ito H. A Case of Protein-Losing Enteropathy Treated with Methotrexate in a Dog. J Vet Med Sci 2006, 68: 397-399.
18. Dandrieux J, Noble P, Scase T, Cripps P, German A. Comparison of a chlorambucil-prednisolone combination with an azathioprineprednisolone combination for treatment of chronic enteropathy with concurrent protein-losing enteropathy in dogs: 27 cases (2007–2010). J Am Vet Med Assoc 2013, 242: 1705-1714.
19. Jergens A, Schreiner A, Frank D, Niyo Y, Ahrens F, Eckersall P, Benson T, Evans R. A Scoring Index for Disease Activity in Canine Inflammatory Bowel Disease. J Vet Intern Med 2003, 17: 291-297.
20. Nakashima K, Hiyoshi S, Ohno K, Uchida K, Goto-Koshino Y, Maeda S, Mizutani N, Takeuchi A, TsuJimoto H. Prognostic factors in dogs with protein-losing enteropathy. Vet J 2015, 205: 28-32.



