> Περίληψη
Η κρανιοεγκεφαλική κάκωση (ΚΕΚ) παρατηρείται συχνά στον σκύλο και στην γάτα και προκαλείται κυρίως από τροχαία ατυχήματα, πτώσεις από ύψος, βίαιες ανθρώπινες ενέργειες ή από επιθέσεις ζώων. Οι βλάβες της ΚΕΚ διακρίνονται σε πρωτογενείς και δευτερογενείς. Οι πρωτογενείς προκύπτουν αμέσως, ως αποτέλεσμα της άμεσης μηχανικής καταστροφής του νευρικού ιστού τη στιγμή του τραυματισμού, ενώ οι δευτερογενείς εμφανίζονται σε λίγα λεπτά ή ημέρες μετά τον τραυματισμό και οφείλονται σε συστηματικές εξωκρανιακές βλάβες και σε ενδοκρανιακές βιοχημικές μεταβολές.
Η αρχική κλινική εκτίμηση της κατάστασης των ζώων με ΚΕΚ εστιάζεται στις άμεσα απειλητικές για τη ζωή διαταραχές και ακολουθείται από τη νευρολογική εξέταση.
Η πρωτογενής εγκεφαλική βλάβη είναι δύσκολο να ελεγχθεί από τον κτηνίατρο. Οι θεραπευτικές προσπάθειες πρέπει να αρχίσουν άμεσα και να επικεντρωθούν στη σταθεροποίηση του ζώου και στην πρόληψη και την αντιμετώπιση των δευτερογενών εγκεφαλικών βλαβών. Αρχικά, λαμβάνονται γενικά μέτρα για την αποκατάσταση και τη διατήρηση της οξυγόνωσης του εγκεφάλου, μέσω της υποστήριξης με υγρά του κυκλοφορικού συστήματος και της χορήγησης οξυγόνου. Στη συνέχεια, λαμβάνονται ειδικά μέτρα που αποσκοπούν στον περιορισμό της βλάβης του εγκεφάλου.
Η ΚΕΚ συνδέεται με υψηλή θνησιμότητα τόσο στα ζώα όσο και στον άνθρωπο. Παρ’ όλα αυτά, οι σκύλοι και οι γάτες έχουν πολύ καλή ικανότητα αποκατάστασης, αν τους δοθεί αρκετός χρόνος μετά ένα σοβαρό τραυματισμό του εγκεφάλου. Για τον λόγο αυτό δεν πρέπει να εξάγονται βιαστικά συμπεράσματα για την πρόγνωση που να βασίζονται μόνο στην αρχική κατάσταση του ζώου με ΚΕΚ.
> Εισαγωγή
Η βαριά κρανιοεγκεφαλική κάκωση (ΚΕΚ) σχετίζε- ται με υψηλά ποσοστά θνησιμότητας, τόσο στον άνθρωπο όσο και στα ζώα1 και μπορεί να προ- κύψει από τροχαίο ατύχημα, πτώση από ύψος, ακούσιες ή σκόπιμες βίαιες ανθρώπινες ενέργειες, επιθέσεις και δήγματα ζώων, καθώς και βλήμα όπλου.2 Σε μία πολυκεντρική έρευνα, το 26% των τραυματισμένων σκύλων και το 42% των τραυματισμένων γατών παρουσίαζε ΚΕΚ.3 Σε άλλη έρευ- να 122 σκύλων με ΚΕΚ, οι περισσότεροι προσκο- μίστηκαν ύστερα από τροχαίο ατύχημα.4
Η κατάλληλη αντιμετώπιση αποτελεί πεδίο έντονης έρευνας στη νευροχειρουργική και εντατική θεραπεία, τόσο στην ιατρική του ανθρώπου όσο και των ζώων. Ωστόσο, στην κτηνιατρική πράξη, λόγω έλλειψης επαρκών δεδομένων από αναδρομικές ή/και εκτεταμένες προοπτικές κλινικές μελέτες, οι περισσότερες οδηγίες βασίζονται σε πειραματικές έρευνες, σε μελέτες από την κλινική ιατρική του ανθρώπου και σε προσωπική εμπειρία.1 Πάντως, κοινή πεποίθηση είναι πως η θεραπεία πρέπει να είναι άμεση και επιθετική, ώστε το ζώο να έχει περισσότερες πιθανότητες να επιβιώσει. Μετά την αρχική αντιμετώπιση των συνοδών κακώσεων που απειλούν άμεσα τη ζωή του ζώου, όπως ο ανοιχτός πνευμοθώρακας, η έμφραξη των αεραγωγών κ.λπ. το ενδιαφέρον του κτηνιάτρου στρέφεται στη διατήρηση της πίεσης διαιμάτωσης του εγκεφάλου.5 Οι σκύλοι και οι γάτες έχουν καλή ικανότητα αποκατάστασης, ακόμα και με σημαντική απώλεια εγκεφαλικού ιστού, αν τους δοθεί αρκετός χρόνος ύστερα από ένα σοβαρό τραύμα του εγκεφάλου.
> Παθογένεια της ΚΕΚ
Η ΚΕΚ συνίσταται από πρωτογενείς και δευτερογενείς εγκεφαλικές βλάβες. Οι πρώτες προκύπτουν άμεσα, ως αποτέλεσμα της μηχανικής καταστροφής του νευρικού ιστού τη στιγμή του τραυματισμού και κινούν σύνθετες φλεγμονώδεις διαδικασίες, οι οποίες θα καταλήξουν στις δευτερογενείς. Οι τελευταίες εμφανίζονται σε λίγα λεπτά ή ημέρες μετά τον τραυματισμό και οφείλονται σε ένα συνδυασμό από συστηματικές εξωκρανιακές βλάβες και ενδοκρανιακές βιοχημικές και φυσιολογικές μεταβολές.2
Οι πρωτογενείς βλάβες προκαλούν τη φυσική αποδιοργάνωση των ενδοκρανιακών δομικών στοιχείων και περιλαμβάνουν:
1. τη θλάση
2. τη ρήξη νευραξόνων (αξονική βλάβη)
3. τη μηχανική ρήξη από βύθιση καταγματικού άκρου (εμπιεστικό κάταγμα)
4. το αιμάτωμα
Η ηπιότερη βλάβη που συνοδεύεται από ολιγόλεπτη απώλεια της συνείδησης είναι η διάσειση. Παρότι δεν συνοδεύεται από ιστολογικές μεταβολές του νευρικού ιστού η μετατραυματική συμπτωματολογία ποικίλει.5
Η μηχανική ρήξη του παρεγχύματος είναι η πιο σοβαρή μορφή πρωτογενούς βλάβης. Η άμεση βλάβη των αγγείων μπορεί να καταλήξει σε ενδοκρανιακή αιμορραγία ή/και αγγειογενές οίδημα. Τα αιματώματα διακρίνονται σε αξονικά, τα οποία εντοπίζονται στο παρέγχυμα του εγκεφάλου, και σε περιφερικά, τα οποία εντοπίζονται στον υπαραχνοειδή, υποσκληρίδιο και επισκληρίδιο χώρο και είναι δυνατό να προκαλέσουν συμπίεση του εγκεφάλου και σοβαρή νευρολογική διαταραχή.6 Παλιότερα, υπήρχε η άποψη ότι τα τελευταία είναι σπάνια σε σκύλους και γάτες που πάσχουν από ΚΕΚ. Ωστόσο, νεότερες έρευνες αποδεικνύουν ότι αυτή η μορφή αιμορραγίας παρατηρείται στο 10% των ζώων με ήπια ΚΕΚ και σε πάνω από 80% των ζώων με βαρία ΚΕΚ.7 Η αντιμετώπιση της άμεσης καταστροφής του νευρικού παρεγχύματος που σχετίζεται με τις πρωτογενείς βλάβες είναι πέρα από τις δυνατότητες του κτηνιάτρου, γι’ αυτό και στόχος του είναι η πρόληψη, η αναγνώριση και η θεραπεία της δευτερογενούς βλάβης του εγκεφάλου.8
Οι πρωτογενείς βλάβες κινητοποιούν έναν μεγάλο αριθμό αλληλένδετων βιοχημικών αντιδράσεων, οι οποίες επιδεινώνουν τη βλάβη του εγκεφαλικού ιστού και τελικά προκαλούν το θάνατο των νευρικών κυττάρων, οι οποίες αναφέρονται ως δευτερογενή βλάβη. Η τελευταία επέρχεται κυρίως μέσω της αυξημένης δραστηριότητας των διεγερτικών νευροδιαβιβαστών, της εξάντλησης των ενεργειακών αποθεμάτων, της παραγωγής ενεργών ριζών οξυγόνου και προφλεγμονωδών κυτταροκινών, οι οποίες προκαλούν βλάβη στα νευρικά κύτταρα. Ακόμη διαπιστώνεται ενδοκυτταρική αύξηση της συγκέντρωσης των ιόντων νατρίου και ασβεστίου και εξωκυτταρική αύξηση της συγκέντρωσης των ιόντων καλίου, συσσώρευση γαλακτικού οξέος, διαταραχή του ομοιοστατικού μηχανισμού πήξης/ινωδόλυσης και κινητοποί- ηση του συμπληρώματος. Πιθανά επακόλουθα των δευτερογενών βλαβών του νευρικού ιστού αποτελούν το οίδημα, η αυξημένη ενδοκρανιακή πίεση, οι μεταβολές στην ακεραιότητα του αιματοεγκεφαλικού φραγμού και οι μεταβολές στην καρδιοαγγειακή δραστηριότητα.1,8,9
Εκτός από τις προαναφερθείσες ενδοκρανιακές βλάβες, στην εκδήλωση της δευτερογενούς βλά- βης μπορεί να συμβάλουν και οι συστηματικές επιπτώσεις του αρχικού τραύματος. Σε αυτές συμπεριλαμβάνονται η υπόταση, η υποξία, η υπό- ή υπεργλυκαιμία, η υπό- ή υπερκαπνία και η υπερθερμία.1,5 Αυτές οι εξωκρανιακές καταστάσεις μπορεί να επιδεινώσουν το εγκεφαλικό τραύμα, ως αποτέλεσμα της δυσχερούς εγκεφαλικής αιμάτωσης, ενώ μπορεί να παρατηρηθεί και κήλη τμημάτων του εγκεφάλου (όπως για παράδειγμα της παρεγκεφαλίδας δια του ινιακού τρήματος).10
Ενδοκρανιακή πίεση
Στην τραυματισμένη περιοχή του εγκεφάλου, ενώ η μεταβολική δραστηριότητα διατηρείται ή αυξάνεται, η ροή του αίματος μειώνεται, με συνέπεια η παροχή οξυγόνου, γλυκόζης και μορίων τριφωσφορικής αδενοσίνης να περιορίζεται. Έτσι, οι αντλίες ιόντων στις κυτταρικές μεμβράνες αδρανούν, με αποτέλεσμα τη συσσώρευση νατρίου, ασβεστίου (ενδοκυτταρικά) και καλίου (εξωκυτ- ταρικά) και την πρόκληση κυτταροτοξικού οιδήματος. Είναι λοιπόν σαφής η σημασία που έχει η διατήρηση της ροής του αίματος στον εγκέφαλο (ΡΑΕ).11
Η ΡΑΕ εξαρτάται από την πίεση διαιμάτωσης του εγκεφάλου (ΠΔΕ) και από την αντίσταση των αγγείων του εγκεφάλου (ΑΑΕ) και ορίζεται ως εξής:
ΡΑΕ = ΠΔΕ / ΑΑΕ11
Μέσω των τοπικών αντισταθμιστικών μηχανι- σμών που ρυθμίζουν την ΑΑΕ, η ΡΑΕ είναι δυνατό να διατηρείται σταθερή σε διακυμάνσεις της τιμής της μέσης αρτηριακής πίεσης (MAΠ) από 50-150 mmHg. Οι αυτορρυθμιστικοί μηχανισμοί εξαρτώνται από την οξεοβασική κατάσταση του ιστού τοπικά, την επαρκή παροχή οξυγόνου και την αντίστοιχη απομάκρυνση του CO2. Όταν, όμως, διαταράσσονται οι αυτορρυθμιστικοί μηχανισμοί, όπως συμβαίνει στην ΚΕΚ, παρατηρείται ότι η ΡΑΕ εξαρτάται ακόμη περισσότερο από τη ΠΔΕ. Συνεπώς, ακόμα και μικρές μειώσεις της ΠΔΕ μπορεί να προκαλέσουν μεταβολές στη ΡΑΕ και να καταλήξουν σε ισχαιμία του εγκεφαλικού παρεγχύματος.2,9,11
Η πίεση διαιμάτωσης του εγκεφάλου (ΠΔΕ) είναι η δύναμη που ωθεί το αίμα στον εγκέφαλο, παρέχοντας το απαραίτητο οξυγόνο και τα θρεπτικά συστατικά στο παρέγχυμά του. Επίσης είναι ο κύριος παράγοντας που καθορίζει τη ΡΑΕ και ορίζεται ως η διαφορά μεταξύ της ΜΑΠ και της ενδοκρανια- κής πίεσης (ΕΠ), δηλαδή:
ΠΔΕ = MAΠ – ΕΠ11
Η αυξημένη ΕΠ είναι μια συχνή και πιθανώς θανατηφόρα συνέπεια της ΚΕΚ. Η ΕΠ είναι η πίεση που επικρατεί μέσα στον θόλο του κρανίου και ασκείται από το εγκεφαλικό παρέγχυμα, το αρτηριακό και φλεβικό αίμα, καθώς και το εγκεφαλονωτιαίο υγρό (ΕΝΥ). Φυσιολογικά κυμαίνεται από 5 έως 12mmHg. Όταν αυξάνεται ο όγκος ενός από τα προαναφερθέντα ανατομικά στοιχεία, αντισταθμιστικά προκειμένου να μην αυξηθεί η ΕΠ, πρέπει να μειωθεί ο όγκος ενός ή και των δύο άλλων, ιδιότητα η οποία είναι γνωστή ως ενδοκρανιακή ενδοτικότητα. Η ενδοκρανιακή ενδοτικότητα μειώνεται όσο αυξάνεται η ΕΠ. Αν η τελευταία αυξηθεί πέρα από τα όρια που θέτει η αποτελεσματικότητα των αντισταθμιστικών μηχανισμών, η εγκεφαλική διαιμάτωση μειώνεται και εμφανίζεται ισχαιμία του εγκεφαλικού ιστού.9-13
Στην ΚΕΚ, επειδή το κύτος του κρανίου είναι σταθερών διαστάσεων, όταν αυξάνεται ο ενδοκρανιακός όγκος, λόγω οιδήματος του εγκεφάλου ή αιμορραγίας, παρατηρείται αύξηση της ΕΠ. Οι σοβαρές αυξήσεις της ΕΠ κινητοποιούν το ισχαιμικό αντανακλαστικό του εγκεφάλου ή αντανακλαστικό Cushing. Συγκεκριμένα, η μείωση της ροής του αίματος στον εγκέφαλο, οδηγεί σε αύξηση της συγκέντρωσης του CO2, η οποία ανιχνεύεται από το αγγειοκινητικό κέντρο. Το τελευταίο διεγείρει το συμπαθητικό νευρικό σύστημα και προκαλεί αύξηση της MAΠ, σε μια προσπάθεια του οργανισμού να αυξήσει την ΠΔΕ. Η συστηματική υπέρταση ανιχνεύεται από τους πιεσοϋποδοχείς των τοιχωμάτων των καρωτίδων αρτηριών και του αορτικού τόξου και προκαλείται αντισταθμιστική βραδυκαρδία. Το ισχαιμικό αντανακλαστικό εμφανίζεται με καθυστέρηση και πιθανώς υποδεικνύει απειλητική για τη ζωή αύξηση της ΕΠ, η οποία πρέπει να οδηγήσει τον κτηνίατρο στην ανάληψη επιθετικής αποιδηματικής θεραπείας.14,15
Σε περιπτώσεις που μειώνεται η ΜΑΠ (συστηματική υπόταση), μειώνεται και η ΠΔΕ, με αποτέλεσμα την ανεπαρκή παροχή αίματος στον εγκέφαλο και την υποξία του νευρικού ιστού. Η αγγειοδιαστολή που παρατηρείται στα αγγεία του εγκεφάλου κατά την υπόταση δεν επαρκεί για τη διατήρηση της ΠΔΕ. Επιπλέον, οι δευτερογενείς αυτολυτικές διαδικασίες στον νευρικό ιστό επιδεινώνονται από την υπάρχουσα υπόταση και υποξαιμία και καταλήγουν σε περεταίρω βλάβη του εγκεφαλικού ιστού, οίδημα και αύξηση της ΕΠ.15,16
Σε ανθρώπους με ΚΕΚ παρατηρούνται συχνά επεισόδια υπεργλυκαιμίας και θεωρείται ότι σχετίζονται με αρνητική πρόγνωση.17 Ο τρόπος εφοδιασμού του εγκεφάλου με ενέργεια είναι ο οξειδωτικός μεταβολισμός της γλυκόζης. Η διαταραχή του μεταβολισμού του εγκεφάλου, σε συνδυασμό με την αύξηση των ενεργειακών αναγκών σε γλυκόζη που παρατηρούνται σε ασθενείς με ΚΕΚ, οδηγεί σε μειωμένη παροχή ενέργειας.18 Ακόμη, παρατηρείται ενεργοποίηση του συμπαθητικού συστήματος και αυξημένη έκκριση κατεχολαμινών, η οποία προκαλεί αύξηση της ΕΠ, αυξημένες ανάγκες σε οξυγόνο και αύξηση του επιπέδου γλυκόζης στο αίμα.19 Η υπεργλυκαιμία αυτή, η οποία αποτελεί ένδειξη του συνδρόμου καταπόνησης, σχετίζεται με τη σοβαρότητα της βλάβης στον σκύλο και τη γάτα, αλλά δεν έχει συνδεθεί με την πρόγνωση.4 Γι’ αυτό, στα ζώα με ΚΕΚ, πρέπει να γίνεται προσδιορισμός της γλυκόζης του αίματος, αν και στον άνθρωπο το επίπεδό της στο περιφερικό αίμα δεν συμβαδίζει απόλυτα με εκείνο στον εγκέφαλο.17
> Εκτίμηση της κατάστασης του ζώου με ΚΕΚ
Η εκτίμηση της κατάστασης των ζώων με ΚΕΚ αρχίζει από τις άμεσα απειλητικές για τη ζωή τους διαταραχές. Μελέτες έδειξαν ότι περίπου 60% των ανθρώπων με ΚΕΚ παρουσίαζαν σύνοδους τραυματισμούς20 και το 25% αυτών αφορούσαν σε ενδοθωρακικά ή ενδοκοιλιακά όργανα. Όπως σε κάθε τραυματισμένο ζώο, αρχικά διερευνώνται και αντιμετωπίζονται βλάβες που αφορούν στους αεραγωγούς, στην αναπνευστική λειτουργία και στην κυκλοφορία του αίματος. Η υποογκαιμία και η υποξαιμία σχετίζονται με αυξημένη θνησιμότητα σε ανθρώπους με ΚΕΚ1,14 και για το λόγο αυτό ο κλινικός πρέπει να μπορεί να τις αναγνωρίσει και να τις αντιμετωπίσει άμεσα. Παράλληλα, ο άμεσος ή συνεχής έλεγχος των ζωτικών λειτουργιών προλαμβάνει την εμφάνισή τους.8
Η νευρολογική κατάσταση του ζώου με ΚΕΚ συχνά δεν είναι σταθερή, οπότε απαιτούνται επαναλαμβανόμενες εκτιμήσεις. Η αρχική νευρολογική εξέταση περιλαμβάνει την εκτίμηση του επίπεδου συνείδησης, του μεγέθους της κόρης του οφθαλμού και της ανταπόκρισής της στο φως, της θέσης και των κινήσεων του οφθαλμού, καθώς και της κινητικότητας των άκρων.5
Στον άνθρωπο, η ΚΕΚ χαρακτηρίζεται ως ήπια, μέτρια ή σοβαρή, με κριτήριο την κλίμακα της Γλασκώβης (Glasgow Coma Scale - GCS). Στην κτηνιατρική χρησιμοποιείται μια τροποποιημένη κλίμακα της Γλασκώβης (Modified Glasgow Coma Scale - MGCS), σύμφωνα με την οποία αξιολογούνται:
- Το επίπεδο συνείδησης.
- Η κινητική δραστηριότητα (περιλαμβάνεται και η θέση του σώματος του ζώου).
- Η δραστηριότητα του στελέχους (μέγεθος κόρης, αντίδραση κόρης στο φως, δραστηριότητα αίθουσας).8
Καθεμιά από τις τρεις κατηγορίες αξιολόγησης βαθμολογείται από 1 (η χειρότερη δυνατή εικόνα) έως 6 (φυσιολογική εικόνα). Το άθροισμα μπορεί να είναι από 3 έως 18. Όσο υψηλότερο είναι το άθροισμα, τόσο καλύτερη είναι η πρόγνωση. Στην κτηνιατρική έχει ελεγχθεί η προγνωστική σημασία της αξιολόγησης, με βάση την τροποποιημένη κλίμακα της Γλασκώβης, σε σχέση με την επιβίωση τις πρώτες 48 ώρες μετά το ατύχημα.21 Το άθροισμα κάθε δεδομένη χρονική στιγμή είναι δείκτης της βαρύτητας της υποκείμενης εγκεφαλικής βλάβης, της εξέλιξης της βλάβης και των αποτελεσμάτων των θεραπευτικών προσπαθειών. Στους ανθρώπους, εάν το άθροισμα κυμαίνεται από 3-9 τις πρώτες 24 ώρες, η βαθμολογία σχετίζεται γραμμικώς με κακή πρόγνωση.22 Πάντως, αυτά τα αναδρομικά μοντέλα πρόγνωσης πιθανώς να μην είναι τόσο χρήσιμα όσο φαίνονται αρχικά, ενώ μέχρι στιγμής δεν υπάρχουν προοπτικές μελέτες.21 Προτείνεται, λοιπόν, η κλίμακα να χρησιμοποιείται ως κλινικό εργαλείο αξιολόγησης της προόδου των νευρολογικών συμπτωμάτων.
Το επίπεδο συνείδησης είναι το πιο αξιόπιστο εμπειρικό μέσο αξιολόγησης της διαταραχής της εγκεφαλικής λειτουργίας ύστερα από ΚΕΚ και παρέχει πληροφορίες για τη λειτουργική ικανότητα του εγκεφαλικού φλοιού και του ανιόντος δικτυωτού σχηματισμού. Συχνά, σε βλάβη τους παρατηρείται κώμα ή λήθαργος. Αυτοί οι ασθενείς χαρακτηρίζονται από επιφυλακτική πρόγνωση.10,23
Η κινητική δραστηριότητα του ζώου ελέγχεται από τον ερυθρό πυρήνα στο μέσο εγκέφαλο και μπορεί να επηρεάζεται από το επίπεδο συνείδησης του ζώου. Ανώμαλη στάση, όπως οπισθότονος και υπερέκταση των άκρων, μπορεί να παρατηρηθεί σε αποσύνδεση του στελέχους και του τελικού εγκεφάλου (ανεγκεφαλική ακαμψία) και πρέπει να γίνει διάκρισή της από την παρεγκεφαλιδική ακαμψία και το σύνδρομο Schiff-Sherrington (Εικόνες 1, 2 και 3). Πάντως, η κύρια διαφορά μεταξύ εγκεφαλικής και παρεγκεφαλιδικής βλάβης είναι το επίπεδο συνείδησης, καθώς στην παρεγκεφαλιδική ακαμψία υπάρχει συνείδηση, ενώ η βλάβη του μέσου εγκεφάλου καταλήγει σε κωματώδη κατάσταση με κακή πρόγνωση.21,23 Σε εντοπισμένες βλάβες, η κινητική διαταραχή εντοπίζεται στο ετεροπλάγιο ημιμόριο του σώματος. Οι δοκιμές της ιδιοδεκτικής αισθητικότητας εμφανίζονται μειωμένες ομόπλευρα, αν η βλάβη αφορά στο στέλεχος, και ετερόπλευρα, αν εντοπίζεται στον φλοιό.24

Η σωστή λειτουργία του εγκεφαλικού στελέχους διαπιστώνεται με τη νευρο-οφθαλμολογική εξέταση. Συγκεκριμένα ελέγχονται οι εγκεφαλικές συζυγίες, το μέγεθος και η ανταπόκριση της κόρης στο φως. Η σωστή αντίδραση της κόρης δείχνει καλή λειτουργία του πρόσθιου εγκεφαλικού στελέχους, του οπτικού χιάσματος, των οπτικών νεύρων και του αμφιβληστροειδή. Η μυδρίαση μπορεί να υποδηλώνει κήλη των εγκεφαλικών ημισφαιρίων του εγκεφάλου, ενώ οι σταθερές και μεσαίου μεγέθους κόρες που δεν ανταποκρίνονται στα φωτεινά ερεθίσματα παρουσιάζονται σε κήλη της παρεγκεφαλίδας. Το αντανακλαστικό της απειλής παρότι χρησιμεύει στη νευροανατομική εντόπιση της βλάβης, εντούτοις δεν συμμετέχει στον καθορισμό της πρόγνωσης. Προγνωστική σημασία έχει, επίσης, η λειτουργία του αιθουσαίου συστήματος, η οποία κλινικά εκτιμάται από την παρουσία παθολογικού ή φυσιολογικού νυσταγμού.10,14,25
Η εκτίμηση των αναπνευστικών κινήσεων, αν και δεν περιλαμβάνεται στην MGCS, μπορεί να συμβάλει τόσο στη νευροανατομική εντόπιση της βλάβης, όσο και στην εκτίμηση της βαρύτητάς της. Ταυτόχρονα με την ΚΕΚ μπορεί να παρατηρηθεί δυσλειτουργία του αναπνευστικού συστήματος, καθώς στους συνυπάρχοντες τραυματισμούς συχνά αναφέρονται πνευμοθώρακας, αιμοθώρακας, κατάγματα πλευρών και κακώσεις του πνεύμονα και του ανώτερου αναπνευστικού συστήματος. Η λειτουργία του αναπνευστικού συστήματος είναι σημαντική για την ΚΕΚ, καθώς μπορεί να επηρεάσει τον μεταβολισμό του νευρικού ιστού.14 Μια σοβαρή αναπνευστική δυσλειτουργία που πιθανώς να εμφανιστεί είναι το νευρογενές πνευμονικό οίδημα (NΠE), το οποίο αποδίδεται σε διέγερση του συμπαθητικού συστήματος και σε αυξημένη έκκριση κατεχολαμινών. Το NΠE, αν και ενδέχεται να έχει σοβαρές συνέπειες, συνήθως αυτοπεριορίζεται μέσα σε λίγες ώρες ή ημέρες.26
Ακόμα, πρέπει να παρακολουθούνται η τιμή του αιματοκρίτη, καθώς και η συγκέντρωση των πρωτεϊνών, της γλυκόζης και των ηλεκτρολυτών στο αίμα, δίνοντας ιδιαίτερη έμφαση στο επίπεδο της γλυκόζης του ορού γιατί, όπως αναφέρθηκε, φαίνεται πως η υπεργλυκαιμία σχετίζεται με τη βαρύτητα της ΚΕΚ σε ανθρώπους και ζώα.4,27,28
Η απεικονιστική μελέτη του κρανίου ενδείκνυται συχνά και κυρίως σε ζώα που δεν ανταποκρίνονται, ή επιδεινώνονται παρά την αρχική ανταπόκρισή τους, στην επιθετική θεραπεία. Τα απλά ακτινογραφήματα δεν είναι ιδιαίτερα χρήσιμα, αλλά κάποιες φορές αποκαλύπτουν κατάγματα στο κρανίο. Η υπολογιστική τομογραφία (CT) προτιμάται κατά την αρχική μελέτη, σε σχέση με την τομογραφία μαγνητικού συντονισμού (MRI), γιατί παρέχει γρηγορότερη και καλύτερη απεικόνιση τόσο των οστών, όσο και της εντόπισης και της έκτασης των αιμορραγιών. Αντίθετα, η MRI είναι περισσότερο χρήσιμη όταν γίνεται μετά την αρχική σταθεροποίηση του ζώου με σκοπό τον καθορισμό της πρόγνωσης για τη νευρολογική αποκατάσταση του ζώου. Να σημειωθεί ότι η τελευταία είναι και πιο ακριβή εξέταση.5,24
> Αντιμετώπιση της κρανιοεγκεφαλικής κάκωσης
Στόχος της αντιμετώπισης της ΚΕΚ αποτελεί η διατήρηση της προσφοράς οξυγονωμένου αίματος στον νευρικό ιστό και η προστασία του από τις δευτερογενείς μεταβολές (Πίνακας 1). Αυτό επιτυγχάνεται με:
1. Διατήρηση της αιμάτωσης
Όπως προαναφέρθηκε η διατήρηση ικανοποιητικής ροής αίματος στον εγκέφαλο προϋποθέτει αφενός επαρκή ΠΔΕ και αφετέρου σχετικά μικρή αντίσταση στα αγγεία του.13
Εξασφάλιση επαρκούς πίεσης διαιμάτωσης εγκέφαλου
Στην επίτευξη αυτού του στόχου συμβάλλει η αποκατάσταση της υπογκαιμίας και η διατήρηση επαρκούς ΜΑΠ, μέσω της χορήγησης υγρών. Παλαιότερα πιστευόταν ότι η επιθετική ενδοφλέβια χορήγηση υγρών μπορεί να επιδεινώσει το εγκεφαλικό οίδημα. Ωστόσο, δεν υπάρχουν δεδομένα που να υποστηρίζουν την άποψη αυτή και έτσι δεν υπάρχει περιορισμός στη χορήγηση υγρών.29 Επιπλέον, η υπόταση έχει σχετιστεί με αυξημένη νοσηρότητα και θνησιμότητα στον άνθρωπο. Πιο συγκεκριμένα, σε αναδρομική μελέτη, η υπόταση σε περιστατικά ΚΕΚ σχετίστηκε με 150% αύξηση της θνησιμότητας.16 Πιθανώς, και στα ζώα με ΚΕΚ, η υπογκαιμία πρέπει να αποφεύγεται και να αποκαθίσταται ο ενδοαγγειακός όγκος αίματος, ώστε να εξασφαλίζεται η φυσιολογική μέση αρτηριακή πίεση.
Οι απόψεις διίστανται αναφορικά με το είδος των υγρών που πρέπει να χρησιμοποιηθούν στη θεραπεία της ΚΕΚ.30 Οι επιλογές που υπάρχουν είναι τα ισότονα κρυσταλλοειδή, τα υπέρτονα κρυσταλλοειδή και τα συνθετικά κολλοειδή διαλύματα, καθώς και τα παράγωγα του αίματος. Ο ακέραιος αιματοεγκεφαλικός φραγμός είναι διαπερατός στο νερό, αλλά αδιαπέραστος σε ιόντα και κολλοειδή μόρια, εξαιτίας των στενών δεσμών μεταξύ των κυττάρων του τοιχώματος των αγγείων.31 Έρευνες έχουν δείξει ότι τα κολλοειδή διαλύματα δεν ασκούν μεγάλη επίδραση στην περιεκτικότητα του εγκεφάλου σε νερό και στην ΕΠ. Όμως, στον τραυματισμένο εγκέφαλο, ο αιματοεγκεφαλικός φραγμός μπορεί να έχει διαρρηχθεί τοπικά ή συνολικά και, επομένως, μπορεί να γίνει αδιακρίτως διαπερατός σε ιόντα και σε κολλοειδή μόρια.32 Για τον λόγο αυτό υποστηρίχθηκε ότι, σε τέτοιες περιπτώσεις, η μη ορθή επιλογή των υγρών μπορεί να οδηγήσει στη δημιουργία εγκεφαλικού οιδήματος. Παρ’ όλα αυτά, τα πλεονεκτήματα από την αποκατάσταση της ΠΔΕ με κρυσταλλοειδή ή κολλοειδή διαλύματα ξεπερνούν τους πιθανούς κινδύνους.14 Τα ισότονα κρυσταλλοειδή διαλύματα χορηγούνται με ρυθμό που μπορεί να φτάσει τα 90 mL/kg/h στον σκύλο και τα 60 mL/kg/h στη γάτα, ενώ τα συνθετικά κολλοειδή διαλύματα σε όγκο 10-20 mL/kg στον σκύλο και 5 mL/kg στη γάτα, κάθε φορά. Κλινικά, το επιδιωκόμενο αποτέλεσμα διαπιστώνεται κυρίως από την επιβράδυνση της καρδιακής συχνότητας, την αύξηση της αρτηριακής πίεση του αίματος, τη βελτίωση της ποιότητας του σφυγμού και τη βελτίωση του χρώματος των βλεννογόνων.14 Σε κάθε περίπτωση αποφεύγουμε τα υπότονα διαλύματα (π.χ. διάλυμα γλυκόζης 5%, το οποίο αν και ισότονο, συμπεριφέρεται ως υπότονο στον οργανισμό), τα οποία όχι μόνο δεν συνεισφέρουν στην παραμονή υγρών ενδοαγγειακά και άρα στην αύξηση της ΜΑΠ, αλλά προκαλούν μετακίνηση νερού στους διάμεσους ιστούς.33
Μετά τη χορήγηση των υπέρτονων διαλυμάτων παρατηρείται ταχεία αύξηση της ωσμωτικότητας του αίματος, η οποία προωθεί την μετακίνηση υγρών μέσω των τριχοειδών αγγείων από το διάμεσο και ενδοκυτταρικό χώρο στον ενδοαγγειακό. Το αποτέλεσμα είναι μια αξιοσημείωτη και ταχεία αύξηση του ενδοαγγειακού όγκου, η οποία υπερβαίνει τον όγκο των υγρών που έχουν χορηγηθεί.34 Τα υπέρτονα διαλύματα είναι δυνατό να ανατάξουν την υπογκαιμική καταπληξία με μικρότερους όγκους χορήγησης και ίσως είναι η καλύ- τερη επιλογή υγρών για τους ασθενείς με ΚΕΚ.34,35 Χρησιμοποιούνται διαλύματα χλωριούχου νάτριου σε συγκεντρώσεις 15%, 7,5% και 3%, με προ- τιμώμενες τις χαμηλότερες συγκεντρώσεις σε δόσεις 4 mL/kg του διαλύματος 7,5% και 5,3 mL/ kg του διαλύματος 3%. Πάντως, παρά το γεγονός ότι η ανταπόκριση στα υπέρτονα κρυσταλλοειδή είναι άμεση, η επακόλουθη ανακατανομή των υγρών στον οργανισμό έχει ως αποτέλεσμα τη μειωμένη διάρκεια δράσης τους, η οποία περιορίζεται (όπως και στα ισότονα) το πολύ στα 75 λεπτά.36 Η προσθήκη ενός συνθετικού κολλοειδούς διαλύματος παρατείνει τη δράση τους για κάποιες ώρες. Η ταυτόχρονη χορήγηση ενός υπέρτονου και ενός κολλοειδούς διαλύματος είναι πιο αποτελεσματική στην αποκατάσταση του όγκου αίματος από κάθε άλλο διάλυμα χορηγούμενο μόνο του. Έχει προταθεί η χορήγηση 4 mL/kg διαλύματος, το οποίο αποτελείται σε αναλογία όγκου 1:2 από υπέρτονο κρυσταλλοειδές διάλυμα 23,4% και Hetastarch 6%.8 Μετά την αρχική αποκατάσταση του όγκου αίματος, επιβάλλεται η συνεχής ενυδάτωση και μάλιστα όχι με υπέρτονα διαλύματα, τα οποία τείνουν να αφυδατώσουν τους ιστούς, αλλά με ισότονα κρυσταλλοειδή. Η θεραπεία με υγρά πρέπει να καλύπτει τις ανάγκες συντήρησης, αλλά και τις απώλειες που πιθανώς να συνεχίζονται.8
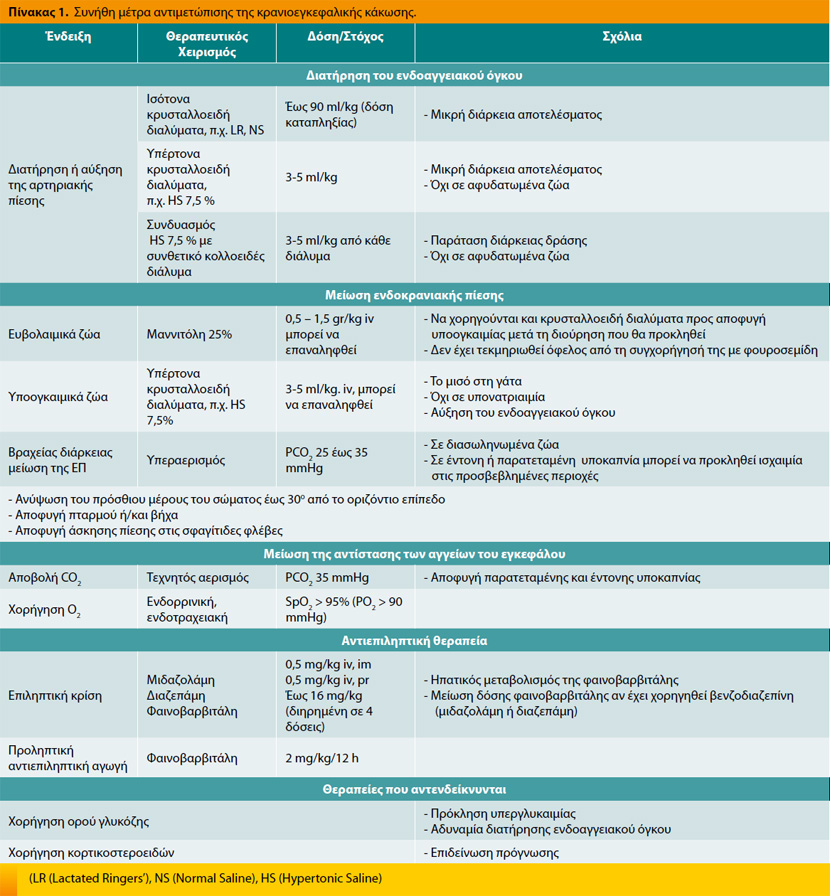
Μείωση της ενδοκρανιακής πίεσης
Για να μειωθεί η ΕΠ μπορεί να χρησιμοποιηθούν απλοί τρόποι. Η τοποθέτηση της κεφαλής του ζώου σε επίπεδο ψηλότερο από αυτό του σώματός του, γεγονός που επιτυγχάνεται με κλίση του τραπεζιού κατά 15-30ο, συμβάλλει στην αύξηση της φλεβικής παροχέτευσης από τον εγκέφαλο και τη μείωση του όγκου αίματός του, χωρίς σοβαρή διαταραχή στην οξυγόνωσή του.8 Είναι σημαντικό να αποφεύγεται η κάμψη του τραχήλου, ώστε να μην παρεμποδίζεται η φλεβική παροχέτευση. Για τον ίδιο λόγο δεν τοποθετούνται περιλαίμια, ούτε σφαγιτιδικοί καθετήρες. Αποφεύγεται ακόμα και η αιμοληψία από τη σφαγίτιδα φλέβα, αφού αυτός ο απλός και βραχύς χειρισμός μπορεί να αυξήσει την ΕΠ.2
Η μαννιτόλη δρα οσμωτικά και είναι το διουρητικό που παραδοσιακά χρησιμοποιείται στη θεραπεία της ΚΕΚ σε ανθρώπους και ζώα.37,38 Θεωρείται θεραπεία πρώτης γραμμής για τη μείωση της ΕΠ και τη βελτίωση της ΠΔΕ.39 Χορηγείται σε δόση 0,5-1,5 g/kg, αργά σε 15-20 λεπτά.40 Η μαννιτόλη αρχικά προκαλεί προσωρινή αύξηση του όγκου του αίματος και μείωση του ιξώδους του. Το γεγονός αυτό οδηγεί σε αγγειοσύσπαση για να διατηρηθεί η αιμάτωση του εγκεφάλου.8 Έτσι, ενώ διατηρείται η αιμάτωσή του εγκέφαλου, μειώνεται η ΕΠ ως αποτέλεσμα της μείωσης του ενδοαγγειακού όγκου αίματος.41 Ο ρεολογικός αυτός μηχανισμός της δράσης της μαννιτόλης θεωρείται υπεύθυνος για την έντονη δράση της, λαμβάνει χώρα αμέσως μετά τη χορήγησή της και διατηρείται για περίπου 75 λεπτά. Η οσμωτική δράση της μαννιτόλης εμφανίζεται 15-30 λεπτά μετά τη χορήγησή της. Σε έναν υγιή εγκέφαλο, η μαννιτόλη προωθεί τη μετακίνηση υγρού από τον διάμεσο και τον ενδοκυτταρικό χώρο προς τον ενδοαγγειακό, προκαλώντας οσμωτική διούρηση. Στο παρελθόν διατυπώθηκε η ανησυχία μήπως η μαννιτόλη, στον τραυματισμένο εγκέφαλο, δεν έχει την ίδια επίδραση λόγω της μειωμένης αιμάτωσης του παρεγχύματος.40 Μια άλλη θεωρητική ανησυχία σχετικά με τη χορήγηση της μαννιτόλης, αφορά στην επιδείνωση της ενδοκρανιακής αιμορραγίας λόγω της οσμωτικής δράσης στον εξωαγγειακό χώρο του τραυματισμένου νευρικού ιστού. Όμως, κλινική απόδειξη για τις θεωρίες αυτές δεν υπάρχει και εφόσον τα οφέλη της θεραπείας ξεπερνούν τους θεωρητικούς κινδύνους, η μαννιτόλη αποτελεί το αποιδηματικό εκλογής στην ΚΕΚ.1,2 Ακόμη, θεωρείται ότι μειώνει τις ελεύθερες ρίζες οξυγόνου.42
Η χορήγηση μαννιτόλης αντενδείκνυται σε υπογκαιμικούς ασθενείς, καθώς η διουρητική δράση της μπορεί να οξύνει την υπογκαιμία και να οδηγήσει σε υπόταση. Γι’ αυτό είναι σημαντικό να χορηγείται μόνο σε ασθενείς με φυσιολογικό όγκο αίματος, οι οποίοι λαμβάνουν την κατάλληλη θεραπεία με κρυσταλλοειδή διαλύματα.10
Τα υπέρτονα διαλύματα NaCl είναι μια ακόμη επιλογή για τη θεραπεία του εγκεφαλικού οιδήματος και της αυξημένης ΕΠ, λόγω της αδυναμίας του νατρίου να διαπεράσει τον αιματoεγκεφαλικό φραγμό. Έτσι, παρουσιάζουν οσμωτική δράση και προκαλούν μετακίνηση νερού από τον ενδοκυτταρικό και το διάμεσο χώρο προς τον ενδοαγγειακό, μειώνοντας τον όγκο του ενδοκυττάριου και του διάμεσου νερού στον εγκέφαλο και κατ΄ επέκταση της ΕΠ. Ακόμα, βελτιώνουν την τοπική αιμάτωση, λόγω της αφυδάτωσης των ενδοθηλιακών κυττάρων του τοιχώματος των αγγείων του εγκεφάλου. Δρουν πολύ γρήγορα και παράλληλα με τη μείωση την ΕΠ σταθεροποιούν το κυκλοφορικό σύστημα. Η δράση τους για την αύξηση του ενδοαγγειακού όγκου διαρκεί 15-75 λεπτά,36 ενώ για τη μείωση της ΕΠ ακόμη περισσότερο.43 Αν χορηγηθούν σε μεγάλες ποσότητες, λόγω της γρήγορης αύξησης του ενδοαγγειακού όγκου, υπάρχει κίνδυνος να επιδεινώσουν τυχόν συνυπάρχον πνευμονικό οίδημα ή θλάση. Ωστόσο, ο ίδιος κίνδυνος ισχύει και για τη μαννιτόλη.44
Αρκετές από τις συγκριτικές μελέτες της χορήγησης μαννιτόλης και υπέρτονων διαλυμάτων έδειξαν ότι με τα τελευταία αντιμετωπίζεται πιο αποτελεσματικά η αυξημένη ΕΠ.43,45 Προς το παρόν, σύμφωνα με τις κατευθυντήριες οδηγίες για τον άνθρωπο, φάρμακο πρώτης επιλογής για τη θεραπεία των ΚΕΚ θεωρείται ακόμα η μαννιτόλη, αν και πρόσφατες έρευνες ενισχύουν το αυξανόμενο κλινικό ενδιαφέρον για τα υπέρτονα διαλύματα, που ίσως είναι πιο αποτελεσματικά και με λιγότερες ανεπιθύμητες ενέργειες.46 Πάντως είναι απαραίτητο να γίνουν και άλλες έρευνες, ώσπου να εξαχθούν ασφαλή συμπεράσματα για τη σωστή χρήση και συγκέντρωση των υπέρτονων διαλυμάτων στις ΚΕΚ στα ζώα.
Στην κτηνιατρική, σε αντίθεση με την ιατρική του ανθρώπου, για τη μείωση της ΕΠ δεν εφαρμόζεται συχνά η χειρουργική αποσυμπίεση (κρανιεκτομή), η οποία ενδείκνυται σε ύπαρξη ξένου σώματος, αιματώματος, συνεχιζόμενης αιμορραγίας, κατάγματος και χωροκατακτητικής βλάβης στο κρανίο, καθώς και σε συνεχώς επιδεινούμενη νευρολογική κατάσταση παρά τη θεραπεία.8
Ρύθμιση της αντίστασης των αγγείων του εγκεφάλου
α. Αερισμός
Ο σημαντικότερος παράγοντας που καθορίζει τη ΡΑΕ και τον όγκο του αίματος στον εγκέφαλο είναι η μερική πίεση του διοξειδίου του άνθρακα στο αρτηριακό αίμα (PaCO2), μέσω της ρύθμισης του τόνου και της διαμέτρου των αγγείων του εγκεφάλου. Συγκεκριμένα, η υπερκαπνία οδηγεί σε αγγειοδιαστολή, μείωση της αντίστασης προβάλλεται στην κίνηση του αίματος και αύξηση της ροής του, η οποία επιφέρει αύξηση του όγκου του αίματος που περιέχεται στον θόλο του κρανίου και έτσι αύξηση της ΕΠ. Η μέτρηση της PaCO2 γίνεται με την ανάλυση των αερίων του αίματος, ενώ σε διασωληνωμένους ασθενείς μετράται το τελοεκπνευστικό CO2 (ET CO2).11 Παραδοσιακά, ως μέθοδος μείωσης της ΕΠ χρησιμοποιείται ο υπεραερισμός των πνευμόνων. Με αυτόν επέρχεται πτώση της PaCO2 οδηγώντας σε σύσπαση των αγγείων του εγκεφάλου, ελάττωση του όγκου του αίματός του και μείωση της ΕΠ. Έχει φανεί ότι ακόμα και μέτρια υποκαπνία (PaCO2 29 - 36 mmHg) οδηγεί σε υπερβολική αγγειοσύσπαση και μείωση της αιμάτωσης των τραυματισμένων περιοχών του εγκεφάλου του ασθενούς, με κίνδυνο ισχαιμίας.47 Συνεπώς, η μέθοδος αυτή πρέπει να χρησιμοποιείται με προσοχή και κυρίως ως μέτρο προσωρινής αντιμετώπισης απότομων αυξήσεων της ΕΠ και επιδείνωσης της νευρολογικής εικόνας, ενώ η PaCO2 πρέπει να διατηρείται μεταξύ 29 και 36 mmHg.47
β. Οξυγόνωση
Η μειωμένη παροχή οξυγόνου είναι από τους κυριότερους παράγοντες που συντελούν στις δευτερογενείς βλάβες του εγκεφάλου. Η διατήρηση αναερόβιου περιβάλλοντος στον εγκέφαλο, εκτρέπει τον μεταβολισμό προς την αναερόβια κατεύθυνση προκαλώντας οξέωση τοπικά. Η τελευταία έχει ανάλογες με την υπερκαπνία επιπτώσεις στον τόνο των αγγείων. Έρευνες στον άνθρωπο έχουν δείξει ότι η θνησιμότητα των ασθενών με επιβεβαιωμένη υποξία είναι διπλάσια από αυτών με φυσιολογική οξυγόνωση των ιστών.16 Έτσι, η χορήγηση οξυγόνου είναι επιβεβλημένη για τους ασθενείς με ΚΕΚ. Το ποσοστό κορεσμού της αιμοσφαιρίνης (Sp02) πρέπει να διατηρείται πάνω από 95%, τιμή που αντιστοιχεί σε μερική πίεση του Ο2 στο αρτηριακό αίμα (PaO2) τουλάχιστον 80 mmHg. Αν είναι δυνατή η μέτρηση των αερίων του αρτηριακού αίματος, επιδιώκεται η PaO2 να είναι τουλάχιστον 90 mmHg. Το οξυγόνο μπορεί να χορηγηθεί με προσωπίδα, ρινικό καθετήρα, τραχειακό καθετήρα, τραχειοσωλήνα, μέσω τραχειοστομίας ή με την τοποθέτηση του ζώου σε κλωβό οξυγόνου. Όμως, στις περιπτώσεις ασθενών με ΚΕΚ, η χρήση κλωβού οξυγόνου είναι αναποτελεσματική, καθώς εμποδίζει τη συνεχή παρακολούθηση (monitoring) και τους διαρκείς χειρισμούς που απαιτούνται, αφού για επιτευχθούν θεραπευτικές συγκεντρώσεις Ο2 πρέπει η πόρτα του κλωβού να είναι κλειστή επί μακρόν. Κατά την οξυγονοθεραπεία, πρέπει να αποφεύγεται ο βήχας (π.χ. διασωλήνωση), ο πταρμός (π.χ. ρινικοί καθετήρες) και γενικά κάθε παράγοντας που μπορεί να αυξήσει την ΕΠ.1
2. Νευροπροστασία
Τα κορτικοστεροειδή χρησιμοποιούνταν ευρέως στη θεραπεία των ΚΕΚ με σκοπό τη μείωση της ΕΠ για περισσότερα από 30 χρόνια. Λόγω έλλειψης επαρκών δεδομένων συστάθηκε μια μεγάλη ερευνητική ομάδα, η οποία διεξήγαγε μια ευρεία προοπτική τυχαιοποιημένη μελέτη (CRASH) για την χρήση των κορτικοστεροειδών στην ΚΕΚ. Από την έρευνα αυτή προέκυψε ότι στην ομάδα των ασθενών που χορηγούνταν κορτικοστεροειδή, οι θάνατοι ήταν σημαντικά αυξημένοι εντός 2 εβδομάδων από την ΚΕΚ. Για λόγους ηθικής η μελέτη ολοκληρώθηκε νωρίτερα.48 Σήμερα θεωρείται ότι η χορήγηση κορτικοστεροειδών στους ασθενείς με ΚΕΚ, συμπεριλαμβανομένης της μεθυλοπρεδνιζολόνης, πιθανώς αυξάνει τη θνησιμότητα48,49 και θεωρούνται επιβλαβή ή τουλάχιστον αναποτελεσματικά.50 Επιπλέον, ενοχοποιούνται για την πρόκληση υπεργλυκαιμίας, ανοσοκαταστολής, καθυστερημένης επούλωσης των τραυμάτων, γαστρικού έλκους και επιδείνωσης του μεταβολισμού. Ως εκ τούτου τα κορτικοστεροειδή δεν προτείνονται ούτε στην κτηνιατρική.14
Η υπεργλυκαιμία έχει δυσμενείς επιπτώσεις στις δευτερογενείς βλάβες και είναι δείκτης βαρύτητας του τραύματος του νευρικού ιστού, ειδικά κατά τις πρώτες 24 ώρες.51 Επίσης, στον άνθρωπο, έχει συσχετιστεί με κακή πρόγνωση, αφού περιστατικά με επίπεδα γλυκόζης στο αίμα πάνω από 200 mg/dl είχαν αρνητική έκβαση.27 Σε ανάλογο συμπέρασμα κατέληξε έρευνα σε ζώα, στα οποία προκλήθηκε πειραματικά ΚΕΚ.28 Αυτός είναι ένας ακόμη λόγος, εκτός από εκείνον που σχετίζεται με την οσμωτική συμπεριφορά του, που στην αντιμετώπιση της ΚΕΚ δεν χρησιμοποιείται διάλυμα γλυκόζης 5%. Η ιατρογενής υπεργλυκαιμία (π.χ. χορήγηση κορτικοστεροειδών) πρέπει οπωσδήποτε να αποφεύγεται,4 ενώ η διατήρηση του επιπέδου γλυκόζης σε στενά όρια στον άνθρωπο, γίνεται μέσω συνεχών μετρήσεών της και της χρήσης ινσουλίνης, όποτε αυτή χρειάζεται.17
Η υποθερμία (32 – 34 oC) έχει χρησιμοποιηθεί σε ανθρώπους52,53 και, πρόσφατα, σε σκύλους με ΚΕΚ54 και φαίνεται πως μειώνει τις μεταβολικές απαιτήσεις του εγκεφάλου, το εγκεφαλικό οίδημα και την ΕΠ. Η κλινική αποτελεσματικότητά της αμφισβητείται, αλλά σίγουρα η υπερθερμία πρέπει να αποφεύγεται.8
3. Άλλα μέτρα
- Αναλγησία, συνήθως, με τη χρήση οπιοειδών.55
- Διατήρηση του ζώου σε κεκλιμένο επίπεδο γωνίας κλίσης περίπου 30°, με το κεφάλι στο υψηλότερο επίπεδο.56
- Κώμα βαρβιτουρικών, μόνο όταν όλα τα άλλα μέτρα αποτύχουν, καθώς μπορεί να είναι καταστροφικό για την επιβίωση του ζώου, αφού οδηγεί σε υπόταση και υποαερισμό.8
- Χορήγηση Η2-αναστολέων ή αναστολέων αντλίας πρωτονίων και σουκραλφάτης για προφύλαξη από το γαστρικό έλκος που εμφανίζεται σε περιπτώσεις γαστρεντερικής αιμορραγίας σε ασθενείς με ΚΕΚ.57
- Εντερική διατροφή και ταυτόχρονη θεραπεία με προκινητικούς παράγοντες και τοποθέτηση ρινοοισοφαγικού καθετήρα. Σε ασθενείς με απώλεια συνείδησης ή του φαρυγγικού αντανακλαστικού προτείνεται παρεντερική διατροφή.8
4. Πρόγνωση της κρανιοεγκεφαλικής κάκωσης
Οι ασθενείς με ΚΕΚ μπορεί να εμφανίσουν διάφορες επιπλοκές, όπως διαταραχές της πήξης του αίματος, πνευμονία, σήψη, παροδικό ή μόνιμο κεντρικό άποιο διαβήτη και επιληπτικές κρίσεις.58 Οι επιληπτικές κρίσεις μπορεί να εμφανιστούν μήνες ή χρόνια μετά την ΚΕΚ.1 Στον άνθρωπο αναφέρονται επιληπτικές κρίσεις σε ποσοστό 4-42% των σοβαρών περιπτώσεων ΚΕΚ,39 όμως στην κτηνιατρική το ποσοστό αυτό είναι άγνωστο και θεωρείται ότι είναι χαμηλό.
Η θεραπεία των ζώων με ΚΕΚ πρέπει να είναι άμεση και επιθετική, ώστε να επιβιώσουν και να επανέλθουν σε επίπεδο αποδεκτό από τον ιδιοκτήτη τους. Ο στόχος της θεραπείας της ΚΕΚ στην κτηνιατρική είναι να εξασφαλιστεί καλή ποιότητα ζωής στο κατοικίδιο ζώο. Πολλά ζώα επανέρχονται, όταν οι συστηματικές και νευρολογικές βλάβες αναγνωρίζονται και θεραπεύονται νωρίς. Οι σκύλοι και οι γάτες με ΚΕΚ, όπως αναφέρθηκε, έχουν αξιοσημείωτη ικανότητα αποκατάστασης, παρά τις απώλειες σε νευρικό ιστό. Συνεπώς, για την πρόγνωση της ΚΕΚ, δεν πρέπει να εξάγονται βιαστικά συμπεράσματα, τα οποία να βασίζονται μόνο στην αρχική κατάσταση του ζώου.8
Οι προγνωστικοί παράγοντες που καθορίζουν την έκβαση της ΚΕΚ στον άνθρωπο είναι η ηλικία, η αιτία της, η βαθμολογία με βάση την κλίμακα της Γλασκώβης, η ανταπόκριση της κόρης του οφθαλμού στο φως, το αποτέλεσμα της υπολογιστικής τομογραφίας, η ύπαρξη υπότασης και υποξίας, καθώς και η τιμή της γλυκόζης και ο χρόνος προθρομβίνης. Στην κτηνιατρική δεν είναι γνωστό ποιοι παράγοντες επηρεάζουν την πρόγνωση της ΚΕΚ, αλλά πρόσφατα στον σκύλο συσχετίστηκε η βαθμολογία με βάση την MGCS με την επιβίωση τις πρώτες 48 ώρες. Έτσι, σε σκύλο με βαθμολογία 8 στην MGCS προβλέπεται επιβίωση 50%. Στην ίδια μελέτη, στην οποία όμως αποκλείστηκαν οι ασθενείς με συστηματικές δυσλειτουργίες, φάνηκε ότι το φύλο, το βάρος, η ηλικία και τα κατάγματα του κρανίου δεν έχουν σχέση με την επιβίωση.21 Παρόλα αυτά, στους ασθενείς με πολλαπλά τραύματα, η MGCS πρέπει να χρησιμοποιείται επιφυλακτικά ως προγνωστικός παράγοντας.8 Συμπερασματικά, η αποτελεσματικότητα της θεραπείας και η πρόγνωση στους ασθενείς με ΚΕΚ, θα είναι πάντα δύσκολο να εκτιμηθεί λόγω του πολυπαραγοντικού χαρακτήρα των τραυμάτων.
> ΒΙΒΛΙΟΓΡΑΦΙΑ
1. Dewey CW. Emergency management of the head trauma patient. Principles and practice. Vet Clin North Am Small Anim Pract. 2000, 30: 207-225.
2. Hopkins AL. Head trauma. Vet Clin North Am Small Anim Pract. 1996, 26: 875-891.
3. Shores A. Craniocerebral Trauma. In: Kirk’s Current Veterinary Therapy. Bonagura JD, Kirk RW, Twedt DC (ed). 10th edn. Elsevier, Saunders: Philadelphia, 1989, p. 847-853.
4. Syring RS, Otto CM, Drobatz KJ. Hyperglycemia in dogs and cats with head trauma: 122 cases (1997-1999). J Am Vet Med Assoc. 2001, 218: 1124-1129.
5. Fletcher DJ. Head trauma management. In: Congress proceedings of the IVECCS. New Orleans, U.S.A., 2007, pp. 403-410.
6. Dewey C, Downs M, Aron D. Acute traumatic intracranial haemorrhage in dogs and cats. A retrospective evaluation of 23 cases. Vet Comp Orthop Traumatol. 1993, 6: 153-8.
7. Platt SR, Radaelli ST, McDonnell JJ. Computed tomography after mild head trauma in dogs. Vet Rec. 2002, 151: 243.
8. Sande A, West C. Traumatic brain injury: a review of pathophysiology and management. J Vet Emerg Crit Care (San Antonio). 2010, 20: 177-190.
9. Chesnut RM. The management of severe traumatic brain injury. Emerg Med Clin North Am. 1997, 15: 581-604.
10. 1Sturges B, LeCouteur RA. Intracranial Hypertension. In: Small Animal Critical Care Medicine. Silverstein DC, Hopper K (ed). 1st edn. Saunders Elsevier: Missouri, 2009, pp. 423-429.
11. Raisis AL, Brearley JC. Anaesthesia, analgesia and supportive care. In: Bsava Manual Of Canine and Feline Neurology. Platt SR, Platt S, Olby NJ (ed). 3rd edn. British Small Animal Veterinary Association: Gloucester 2004, pp. 337-354.
12. Zink BJ. Traumatic brain injury. Emerg Med Clin North Am. 1996, 14: 115-150.
13. Bouma GJ, Muizelaar JP, Bandoh K, Marmarou A. Blood pressure and intracranial pressure-volume dynamics in severe head injury: relationship with cerebral blood flow. J Neurosurg. 1992, 77: 15-19.
14. Syring RS. Assessment and treatment of central nervous system abnormalities in the emergency patient. Vet Clin North Am Small Anim Pract. 2005, 35: 343-358.
15. Guyton AC, Hall JE. Nervous regulation of the circulation, and rapid control of arterial pressure. In: Guyton and Hall Textbook of Medical Physiology. Guyton AC, Hall JE (ed). 11th edn. Elsevier Health Sciences: Philadelphia, 2006, pp. 212-213.
16. Chesnut RM, Marshall LF, Klauber MR, Blunt BA, Baldwin N, Eisenberg HM, Jane JA, Marmarou A, Foulkes MA. The role of secondary brain injury in determining outcome from severe head injury. J Trauma. 1993, 34: 216-222.
17. Rostami E, Bellander BM. Monitoring of glucose in brain, adipose tissue, and peripheral blood in patients with traumatic brain injury: a microdialysis study. J Diabetes Sci Technol. 2011, 5: 596-604.
18. Vespa P, Bergsneider M, Hattori N, Wu HM, Huang SC, Martin NA, Glenn TC, McArthur DL, Hovda DA. Metabolic crisis without brain ischemia is common after traumatic brain injury: a combined microdialysis and positron emission tomography study. J Cereb Blood Flow Metab. 2005, 25: 763-774.
19. Rosner MJ, Newsome HH, Becker DP. Mechanical brain injury: the sympathoadrenal response. J Neurosurg. 1984, 61: 76-86.
20. Siegel JH. The effect of associated injuries, blood loss, and oxygen debt on death and disability in blunt traumatic brain injury: the need for early physiologic predictors of severity. J Neurotrauma. 1995, 12: 579-590.
21. Platt SR, Radaelli ST, McDonnell JJ. The prognostic value of the modified Glasgow Coma Scale in head trauma in dogs. J Vet Intern Med. 2001, 15: 581-584.
22. Maas AI, Dearden M, Teasdale GM, Braakman R, Cohadon F, Iannotti F, Karimi A, Lapierre F, Murray G, Ohman J, Persson L, Servadei F, Stocchetti N, Unterberg A. EBIC-guidelines for management of severe head injury in adults. European Brain Injury Consortium. Acta Neurochir (Wien). 1997, 139: 286-294.
23. Gruen P, Liu C. Current trends in the management of head injury. Emerg Med Clin North Am. 1998, 16: 63-83.
24. Bush WW. Pathophysiology of the head injured patient. In: Congress proceedings of the IVECCS. San Antonio, U.S.A., 2006, pp. 481-485.
25. Scherer MR, Burrows H, Pinto R, Littlefield P, French LM, Tarbett AK, Schubert MC. Evidence of central and peripheral vestibular pathology in blast-related traumatic brain injury. Otol Neurotol. 2011, 32: 571-580.
26. Drobatz KJ, Saunders HM, Pugh CR, Hendricks JC. Noncardiogenic pulmonary edema in dogs and cats: 26 cases (1987-1993). J Am Vet Med Assoc. 1995, 206: 1732- 1736.
27. Rovlias A, Kotsou S. The influence of hyperglycemia on neurological outcome in patients with severe head injury. Neurosurgery. 2000, 46: 335-342.
28. Cherian L, Hannay HJ, Vagner G, Goodman JC, Contant CF, Robertson CS. Hyperglycemia increases neurological damage and behavioral deficits from posttraumatic secondary ischemic insults. J Neurotrauma. 1998, 15: 307-321.
29. Clifton GL, Miller ER, Choi SC, Levin HS. Fluid thresholds and outcome from severe brain injury. Crit Care Med. 2002, 30: 739-745.
30. Zhuang J, Shackford SR, Schmoker JD, Pietropaoli JA, Jr. Colloid infusion after brain injury: effect on intracranial pressure, cerebral blood flow, and oxygen delivery. Crit Care Med. 1995, 23: 140-148.
31. Kaieda R, Todd MM, Cook LN, Warner DS. Acute effects of changing plasma osmolality and colloid oncotic pressure on the formation of brain edema after cryogenic injury. Neurosurgery. 1989, 24: 671-678.
32. Wisner D, Busche F, Sturm J, Gaab M, Meyer H. Traumatic shock and head injury: effects of fluid resuscitation on the brain. J Surg Res. 1989, 46: 49-59.
33. Boag A, Hughes D. Fluid Therapy. In: BSAVA Manual Of Canine and Feline Emergency and Critical Care. King L, Hammond R (ed). British Small Animal Veterinary Association: Gloucester, 2001, pp. 36-37.
34. Kreimeier U, Messmer K. Small-volume resuscitation: from experimental evidence to clinical routine. Advantages and disadvantages of hypertonic solutions. Acta Anaesthesiol Scand. 2002, 46: 625-638.
35. Prough DS, Whitley JM, Taylor CL, Deal DD, DeWitt DS. Regional cerebral blood flow following resuscitation from hemorrhagic shock with hypertonic saline. Influence of a subdural mass. Anesthesiology. 1991, 75: 319-327.
36. Smith GJ, Kramer GC, Perron P, Nakayama S, Gunther RA, Holcroft JW. A comparison of several hypertonic solutions for resuscitation of bled sheep. J Surg Res. 1985, 39: 517-28.
37. McGraw CP, Howard G. Effect of mannitol on increased intracranial pressure. Neurosurgery. 1983, 13: 269-271.
38. Muizelaar JP, Lutz HA, 3rd, Becker DP. Effect of mannitol on ICP and CBF and correlation with pressure autoregulation in severely head-injured patients. J Neurosurg. 1984, 61: 700-706.
39. Bratton SL, Chestnut RM, Ghajar J, McConnell Hammond FF, Harris OA, Hartl R, Manley GT, Nemecek A, Newell DW, Rosenthal G, Schouten J, Shutter L, Timmons SD, Ullman JS, Videtta W, Wilberger JE, Wright DW. Guidelines for the management of severe traumatic brain injury. II. Hyperosmolar therapy. J Neurotrauma. 2007, 24 Suppl 1: S14-20.
40. Marshall LF, RW SM, Rauscher LA, Shapiro HM. Mannitol dose requirements in brain-injured patients. J Neurosurg. 1978, 48: 169-172.
41. Barry KG, Berman AR. Mannitol infusion. III. The acute effect of the intravenous infusion of mannitol on blood and plasma volumes. N Engl J Med. 1961, 264: 1085-1058.
42. Mizoi K, Suzuki J, Imaizumi S, Yoshimoto T. Development of new cerebral protective agents: the free radical scavengers. Neurol Res. 1986, 8: 75-80.
43. Zornow MH, Todd MM, Moore SS. The acute cerebral effects of changes in plasma osmolality and oncotic pressure. Anesthesiology. 1987, 67: 936-941.
44. Qureshi AI, Suarez JI, Bhardwaj A, Mirski M, Schnitzer MS, Hanley DF, Ulatowski JA. Use of hypertonic (3%) saline/acetate infusion in the treatment of cerebral edema: Effect on intracranial pressure and lateral displacement of the brain. Crit Care Med. 1998, 26: 440- 446.
45. Qureshi AI, Wilson DA, Traystman RJ. Treatment of elevated intracranial pressure in experimental intracerebral hemorrhage: comparison between mannitol and hypertonic saline. Neurosurgery. 1999, 44: 1055-1063.
46. Kerwin AJ, Schinco MA, Tepas JJ, 3rd, Renfro WH, Vitarbo EA, Muehlberger M. The use of 23.4% hypertonic saline for the management of elevated intracranial pressure in patients with severe traumatic brain injury: a pilot study. J Trauma. 2009, 67: 277-282.
47. Coles JP, Minhas PS, Fryer TD, Smielewski P, Aigbirihio F, Donovan T, Downey SP, Williams G, Chatfield D, Matthews JC, Gupta AK, Carpenter TA, Clark JC, Pickard JD, Menon DK. Effect of hyperventilation on cerebral blood flow in traumatic head injury: clinical relevance and monitoring correlates. Crit Care Med. 2002, 30: 1950-1959.
48. Roberts I, Yates D, Sandercock P, Farrell B, Wasserberg J, Lomas G, Cottingham R, Svoboda P, Brayley N, Mazairac G, Laloe V, Munoz-Sanchez A, Arango M, Hartzenberg B, Khamis H, Yutthakasemsunt S, Komolafe E, Olldashi F, Yadav Y, Murillo-Cabezas F, Shakur H, Edwards P. Effect of intravenous corticosteroids on death within 14 days in 10008 adults with clinically significant head injury (MRC CRASH trial): randomised placebo-controlled trial. Lancet. 2004, 364: 1321-1328.
49. Edwards P, Arango M, Balica L, Cottingham R, El- Sayed H, Farrell B, Fernandes J, Gogichaisvili T, Golden N, Hartzenberg B, Husain M, Ulloa MI, Jerbi Z, Khamis H, Komolafe E, Laloe V, Lomas G, Ludwig S, Mazairac G, Munoz Sanchez Mde L, Nasi L, Olldashi F, Plunkett P, Roberts I, Sandercock P, Shakur H, Soler C, Stocker R, Svoboda P, Trenkler S, Venkataramana NK, Wasserberg J, Yates D, Yutthakasemsunt S. Final results of MRC CRASH, a randomised placebo-controlled trial of intravenous corticosteroid in adults with head injury-outcomes at 6 months. Lancet. 2005, 365: 1957-1959.
50. Lei J, Gao GY, Jiang JY. Is management of acute traumatic brain injury effective? A literature review of published Cochrane Systematic Reviews. Chin J Traumatol. 2012, 15: 17-22.
51. Liu-DeRyke X, Collingridge DS, Orme J, Roller D, Zurasky J, Rhoney DH. Clinical impact of early hyperglycemia during acute phase of traumatic brain injury. Neurocrit Care. 2009, 11: 151-157.
52. Marion DW, Penrod LE, Kelsey SF, Obrist WD, Kochanek PM, Palmer AM, Wisniewski SR, DeKosky ST. Treatment of traumatic brain injury with moderate hypothermia. N Engl J Med. 1997, 336: 540-546.
53. Clifton GL, Miller ER, Choi SC, Levin HS, McCauley S, Smith KR, Jr., Muizelaar JP, Wagner FC, Jr., Marion DW, Luerssen TG, Chesnut RM, Schwartz M. Lack of effect of induction of hypothermia after acute brain injury. N Engl J Med. 2001, 344: 556-563.
54. Hayes GM. Severe seizures associated with traumatic brain injury managed by controlled hypothermia, pharmacologic coma, and mechanical ventilation in a dog. J Vet Emerg Crit Care (San Antonio). 2009, 19: 629-634.
55. Lauer KK, Connolly LA, Schmeling WT. Opioid sedation does not alter intracranial pressure in head injured patients. Can J Anaesth. 1997, 44: 929-933.
56. Ng I, Lim J, Wong HB. Effects of head posture on cerebral hemodynamics: its influences on intracranial pressure, cerebral perfusion pressure, and cerebral oxygenation. Neurosurgery. 2004 Mar, 54: 593-597; discussion 8.
57. Simons RK, Hoyt DB, Winchell RJ, Holbrook T, Eastman AB. A risk analysis of stress ulceration after trauma. J Trauma. 1995, 39: 289-293.
58. Piek J, Chesnut RM, Marshall LF, van Berkum- Clark M, Klauber MR, Blunt BA, Eisenberg HM, Jane JA, Marmarou A, Foulkes MA. Extracranial complications of severe head injury. J Neurosurg. 1992, 77: 901-907.



