Τσιτσιλιάνου Α. Κτηνίατρος, Κλινική Ζώων Συντροφιάς, Κτηνιατρική Σχολή, Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης, Θεσσαλονίκη, Ελλάδα | Καζάκος Γ. Κτηνίατρος, PhD, Αναπληρωτής Καθηγητής Αναισθησίας και Εντατικής Θεραπείας, Κλινική Ζώων Συντροφιάς, Κτηνιατρική Σχολή, Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης, Θεσσαλονίκη, Ελλάδα | Κωτσίδου Μ. Κτηνίατρος, Κλινική Ζώων Συντροφιάς, Κτηνιατρική Σχολή, Αριστοτέλειο Πανεπιστήμιο Θεσσαλονίκης, Θεσσαλονίκη, Ελλάδα
Λέξεις ευρετηρίου: κακώσεις θωρακοσφυϊκής μοίρας νωτιαίου μυελού, παραπληγία, φυσικοθεραπεία, γεννήτορας κεντρικών προτύπων της κίνησης
Περίληψη
Η επισκληρίδιος αναισθησία - αναλγησία (ΕΑΑ) είναι μια συχνά εφαρμοζόμενη τεχνική επιχώριας αναισθησίας τόσο στην αναισθησία του ανθρώπου όσο και στην αναισθησία μικρών ζώων. Η επισκληρίδιος αναισθησία αναφέρεται στην έγχυση τοπικών αναισθητικών στον επισκληρίδιο χώρο για την περιεγχειρητική απευαισθητοποίηση ενός χειρουργικού πεδίου προκαλώντας αισθητικό, κινητικό και αυτόνομο αποκλεισμό. Η επισκληρίδιος αναλγησία αναφέρεται στην έγχυση οπιοειδών στον επισκληρίδιο χώρο για την περιεγχειρητική και μετεγχειρητική διαχείριση του πόνου. Η χρήση της στην κλινική πρακτική των μικρών ζώων παρέχει βέλτιστες συνθήκες για πληθώρα επεμβάσεων μαλακών μορίων και ορθοπεδικών επεμβάσεων. Η ΕΑΑ μπορεί να παρέχει καλύτερη ποιότητα αναισθησίας μειώνοντας τον πόνο και συνεπώς τις απαιτήσεις σε αναισθητικά και αναλγητικά. Ανάλογα με την επιλογή του φαρμάκου, η ΕΑΑ μπορεί να συμβάλει στην περιεγχειρητική σταθερότητα της αναισθησίας, καθώς και στη μετεγχειρητική άνεση του ασθενούς. Η ΕΑΑ σε σκύλους και γάτες εκτελείται σε διάφορες θέσεις ανάλογα με το επιθυμητό δερμοτόμιο που πρέπει να αναισθητοποιηθεί. Αυτό μπορεί να είναι αυχενικό, θωρακικό, οσφυϊκό, ιεροκοκκυγικό και κοκκυγικό. Η πιο συνηθισμένη θέση για επισκληρίδιο έγχυση είναι μεταξύ του έβδομου οσφυϊκού σπονδύλου και του πρώτου ιερού σπονδύλου. Η επισκληρίδιος χορήγηση τοπικών αναισθητικών και οπιοειδών μπορεί να υλοποιηθεί με μια σειρά διαφορετικών τεχνικών, όπως η τεχνική της κρεμάμενης σταγόνας, η απώλεια αντίστασης, η ανίχνευση εξωσκληρίδιων κυμάτων πίεσης και άλλες. Για να επιτευχθεί η κρανιακή εξάπλωση του τοπικού αναισθητικού και ο επιθυμητός επισκληρίδιος αποκλεισμός απαιτείται ένας ελάχιστος όγκος 0,2mlkg . Ο όγκος αυτός μετράται συνήθως με βάση το σωματικό βάρος, αλλά υπάρχει και μια άλλη τεχνική που εξαρτάται από την απόσταση ινιακού λοβού - κοκκυγικού σημείου. Τα συνήθως χορηγούμενα τοπικά αναισθητικά περιλαμβάνουν τη λιδοκαΐνη, τη βουπιβακαΐνη, τη ροπιβακαΐνη. Έχουν επίσης χρησιμοποιηθεί η μορφίνη, η βουπρενορφίνη, η μεθαδόνη και η τραμαδόλη. Ο επισκληρίδιος αποκλεισμός μπορεί να προκαλέσει ορισμένες παρενέργειες ανάλογα με την επιλογή του φαρμάκου, όπως υποαερισμό δευτερογενώς λόγω αναπνευστικής καταστολής, καρδιαγγειακή καταστολή, νευρολογικές επιπλοκές, κνησμό που σχετίζεται με τα οπιοειδή και κατακράτηση ούρων. Ορισμένες σημαντικές πιθανές επιπλοκές περιλαμβάνουν αποτυχία στην τεχνική, επιμόλυνση και σχηματισμό αιματώματος. Η παρούσα ανασκόπηση αποσκοπεί στην ενημέρωση σχετικά με την τεχνική της ΕΑΑ, τα συνήθως χορηγούμενα τοπικά αναισθητικά και τους συνδυασμούς τους, καθώς και τις πιθανές ανεπιθύμητες ενέργειες που πρέπει να λαμβάνονται υπόψη. Αν και αρχικά αποτελεί πρόκληση, είναι μια ελάχιστα επεμβατική τεχνική η οποία μπορεί να συμπεριληφθεί σε ένα ισορροπημένο αναισθησιολογικό πρωτόκολλο με σχέδιο περιεγχειρητικής διαχείρισης του πόνου.
Εισαγωγή
Η επισκληρίδιος έγχυση αναισθητικών και αναλγητικών φαρμάκων είναι μια συχνά χρησιμοποιούμενη τεχνική επιχώριας αναισθησίας στην πρακτική των μικρών ζώων, η οποία παρέχει αναισθησία και αναλγησία σε διάφορες χειρουργικές επεμβάσεις. Η οσφυοϊερή επισκληρίδιος αναισθησία και αναλγησία παρέχει αναισθησία και αναλγησία ουραία του ομφαλού σε σκύλους και γάτες (Garcia - Pereira 2018). Η επισκληρίδιος αναισθησία παρέχει προληπτική αναλγησία καταστέλλοντας την κεντρική ευαισθητοποίηση, μειώνοντας τον πόνο και τις απαιτήσεις σε εισπνευστικά ή/και οπιοειδή φάρμακα περιεγχειρητικά (Steagall et al. 2017). Επιπλέον, μειώνει την ανάγκη για μετεγχειρητική αναλγησία διάσωσης, καθώς και τις συγκεντρώσεις στο πλάσμα των βιοδεικτών που σχετίζονται με το στρες, της γλυκόζης και της κορτιζόλης, κατά τη διάρκεια της χειρουργικής επέμβασης (Romano et al. 2016, Steagall et al. 2017). Απλή, ασφαλής και φθηνή, η τεχνική αυτή παραμένει ένα χρήσιμο εργαλείο για τον κλινικό ιατρό με μάλλον χαμηλό ποσοστό επιπλοκών (Jones 2001).
Η παρούσα ανασκόπηση χωρίζεται στις ακόλουθες ενότητες:
- Ανατομία του επισκληρίδιου χώρου
- Φαρμακολογικές επιδράσεις των τοπικών αναισθητικών
- Όγκος και κατανομή στον επισκληρίδιο χώρο
- Καρδιαγγειακές επιδράσεις
- Μεταβολισμός και ορμόνες
- Τεχνική
- Τοποθέτηση του ζώου
- Ανατομικά ορόσημα για την οσφυοϊερή επισκληρίδιο αναισθησία
- Ενδείξεις και αντενδείξεις
- Μέθοδοι επιβεβαίωσης της τοποθέτησης της βελόνας στον επισκληρίδιο χώρο
- Βασικός εξοπλισμός για την επισκληρίδιο αναισθησία
- Ενέσιμος όγκος με βάση το σωματικό βάρος & το μήκος της σπονδυλικής στήλης
- Σωματικό βάρος
- Μήκος σπονδυλικής στήλης
- Συχνώς χορηγούμενα φάρμακα και συνδυασμοί φαρμάκων - Τοπικά αναισθητικά
- Οπιοειδή
- Ανεπιθύμητες αντιδράσεις
Ανατομία του επισκληρίδιου χώρου (Εικόνα 1)
Ο σπονδυλικός σωλήνας περιλαμβάνει τον επισκληρίδιο χώρο, τις μήνιγγες (σκληρή μήνιγγα, αραχνοειδής και χοριοειδής μήνιγγα), το εγκεφαλονωτιαίο υγρό και τον νωτιαίο μυελό. Ο νωτιαίος μυελός διέρχεται μέσω του σπονδυλικού σωλήνα από τον εγκέφαλο έως την ουραία οσφυϊκή περιοχή που εκλεπτύνεται στο κωνοειδές άκρο του μυελού (Jones 2001). Απώτερα του άκρου αυτού του νωτιαίου μυελού βρίσκεται η ιππουρίδα. Η σκληρή μήνιγγα συνεχίζει ουραία μετά την απόληξη του νωτιαίου μυελού και σχηματίζει μια μεμβρανώδη θήκη που αναφέρεται ως μηνιγγικός σάκος. Ο μηνιγγικός σάκος τυπικά τελειώνει στο επίπεδο του 6ου οσφυϊκού σπονδύλου (Ο6) και του 7ου οσφυϊκού σπονδύλου (Ο7) στους περισσότερους σκύλους και μεταξύ του Ο7 και του 3ου ιερού σπονδύλου (Ι3) στις περισσότερες γάτες (Campoy 2013).
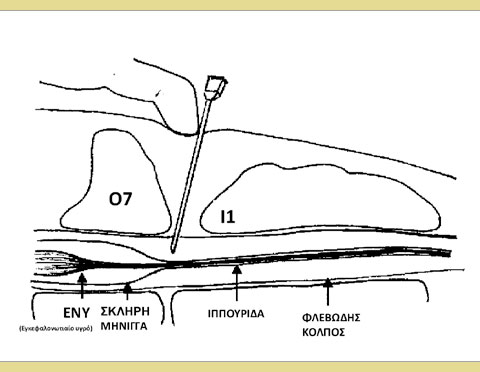
Εικόνα 1: Σχηματική απεικόνιση του επισκληρίδιου χώρου Αστέρι: Το άκρο της βελόνας φαίνεται στον επισκληρίδιο χώρο.
Ο επισκληρίδιος χώρος είναι η «δυνητική» κοιλότητα που βρίσκεται μεταξύ της σκληρής μήνιγγας και των γύρω σπονδύλων. Περιλαμβάνει το εσωτερικό σπονδυλικό φλεβικό πλέγμα καθώς και συνδετικούς και λιπώδεις ιστούς. Ο επισκληρίδιος χώρος διευρύνεται στο επίπεδο του οσφυοϊερού μεσοσπονδύλιου χώρου παρέχοντας την ιδανική θέση για τη διενέργεια επισκληρίδιας αναισθησίας. Υπάρχουν πολλά σημεία για την επισκληρίδιο αναισθησία, όπως η αυχενική, η θωρακική, η οσφυϊκή, η ιεροκοκκυγική και η κοκκυγική, αλλά η παρούσα ανασκόπηση επικεντρώνεται κυρίως στην οσφυοϊερή επισκληρίδιο αναισθησία. Η οσφυοϊερή επισκληρίδιος έγχυση φαρμάκων σε σκύλους και γάτες πραγματοποιείται μεταξύ του Ο7 και του 1ου ιερού σπονδύλου (Ι1) (Jones 2001).
Ο ιεροκοκκυγικός μεσοσπονδύλιος χώρος χρησιμοποιείται για την επισκληρίδιο χορήγηση αναισθητικών διαλυμάτων σε γάτες με σκοπό την απευαισθητοποίηση της περιπρωκτικής χώρας. Δεδομένου ότι ο μηνιγγικός σάκος στις γάτες εκτείνεται ουραία μέχρι το 1o ιερό τρήμα, ο ιεροκοκκυγικός μεσοσπονδύλιος χώρος είναι μια πλεονεκτική θέση όπου η επισκληρίδιος αναισθησία της επιθυμητής περιοχής μπορεί να γίνει με ασφάλεια και να αποφευχθεί η ακούσια πρόσβαση στον υπαραχνοειδή χώρο. Η ιεροκοκκυγική επισκληρίδιος προσπέλαση εξαλείφει τον πιθανό κίνδυνο διάτρησης του νωτιαίου μυελού ή ακούσιας ενδορραχιαίας έγχυσης (Garcia - Pereira, 2018).
Φαρμακολογικές επιδράσεις των τοπικών αναισθητικών
Η επισκληρίδιος χορήγηση τοπικών αναισθητικών προκαλεί αισθητικό, κινητικό και αυτόνομο αποκλεισμό. Μετά την επισκληρίδια χορήγηση, το αναισθητικό διάλυμα διαχέεται διαμέσου της σκληρής μήνιγγας και μέσω των μεσοσπονδύλιων τρημάτων για να δράσει στις νευρικές ρίζες και, τελικά, να αποκλείσει πολλαπλά παρασπονδυλικά νεύρα. Ο αισθητικός αποκλεισμός αποτρέπει την αλγαισθησία, ενώ ο κινητικός αποκλεισμός προκαλεί βαθιά χαλάρωση των σκελετικών μυών που οδηγεί σε απώλεια της κινητικής λειτουργίας (Campoy 2004, Steagall et al. 2017).
Η επίδραση των τοπικών αναισθητικών στον νευρωνικό ιστό σχετίζεται με το μέγεθος των νευρικών ινών και τη μυελίνωσή τους, την επιτυγχανόμενη συγκέντρωση του φαρμάκου και τη διάρκεια της επαφής. Οι μικρού μεγέθους, αμύελες νευρικές ίνες Α-δ και C, οι οποίες είναι υπεύθυνες για τη μετάδοση του πόνου, μπλοκάρονται πιο αποτελεσματικά σε σύγκριση με τις εμμύελες ίνες Α-α και Α-β, οι οποίες είναι υπεύθυνες για την ιδιοδεκτικότητα, την αίσθηση της πίεσης και την κινητική δραστηριότητα. Σύμφωνα με αυτό, μπορεί να επιτευχθεί αισθητικός αποκλεισμός με ελάχιστη έκπτωση της κινητικής λειτουργίας με την έγχυση χαμηλής συγκέντρωσης διαλυμάτων τοπικού αναισθητικού (Campoy 2004, Steagall et al. 2017). Παρ’ όλα αυτά, αυτό δεν ισχύει πάντα, καθώς είναι δυνατόν η χαμηλή συγκέντρωση ενός τοπικού αναισθητικού να προκαλέσει κινητικό αποκλεισμό (Freire et al. 2010). Ο αισθητικός και κινητικός αποκλεισμός που προκαλούν τα τοπικά αναισθητικά επηρεάζεται από διάφορους παράγοντες, συμπεριλαμβανομένης της λιποδιαλυτότητας και της αγγειοδραστικότητας του ίδιου του τοπικού αναισθητικού, του σημείου έγχυσης και της χρησιμοποιούμενης δόσης. Η διαλυτότητα των λιπιδίων είναι ένας παράγοντας που μπορεί να συμβάλει στην έναρξη της δράσης, τη διάρκεια και την εξασθένηση της επισκληρίδιας αναισθησίας. Η προσθήκη αγωνιστών των αδρενεργικών υποδοχέων α-2 μαζί με τα τοπικά αναισθητικά έχει βραδύτερη έναρξη δράσης και βραδύτερη υποχώρηση του κινητικού αποκλεισμού από ό,τι η προσθήκη οπιοειδών. Για παράδειγμα, η μορφίνη έχει ταχύτερη έναρξη της δράσης και ταχύτερη υποχώρηση του κινητικού αποκλεισμού από ό,τι η δεξμεδετομιδίνη (Kamal and Talaat 2014).
Όγκος και κατανομή στον επισκληρίδιο χώρο
Η έκταση του επισκληρίδιου αποκλεισμού εξαρτάται από την κρανιακή κατανομή των τοπικών αναισθητικών φαρμάκων και συσχετίζεται με τον εγχεόμενο όγκο (Freire et al. 2010). Απαιτείται ένας ελάχιστος όγκος για να επιτευχθεί επισκληρίδιος αποκλεισμός και εάν δεν χορηγηθεί αυτός, η ενδεχόμενη αύξηση της συγκέντρωσης του τοπικού αναισθητικού δεν έχει περαιτέρω αποτέλεσμα. Δεν υπάρχει διαφορά εάν ο όγκος εγχύεται στον οσφυ- ϊκό ή στον ιεροκοκκυγικό χώρο. Ωστόσο, η ταχύτητα έγχυσης επηρεάζει την κρανιακή εξάπλωση του διαλύματος τοπικού αναισθητικού και την πίεση που δημιουργείται στον επισκληρίδιο χώρο. Κατά τη χειροκίνητη χορήγηση του ενέσιμου υλικού, δημιουργούνται μεγάλα κύματα που ενισχύουν την κρανιακή εξάπλωση του αναισθητικού διαλύματος στον επισκληρίδιο χώρο (Freire et al. 2010, Garcia- Pereira 2018). Η επισκληρίδιος έγχυση μπορεί να δημιουργηθεί μέσω της προώθησης ενός επισκληριδίου καθετήρα και της χρήσης αντλίας έγχυσης, αλλά η περιγραφή αυτής της τεχνικής ξεπερνά τα όρια της ανασκόπησής μας (Sasauchi et al. 2016).
Καρδιαγγειακές επιδράσεις
Οι συμπαθητικές ίνες εκφύονται από το 1o θωρακικό τρήμα (Θ1) έως το 4o οσφυϊκό τρήμα (Ο4) του νωτιαίου μυελού. Η επισκληρίδιος αναισθησία προκαλεί διαταραχή της νευρικής μετάδοσης εντός του νωτιαίου μυελού, των νωτιαίων νευρικών ριζών καθώς και των γαγγλίων της ραχιαίας ρίζας. Η επισκληρίδιος αναισθησία που επεκτείνεται από το επίπεδο της οπίσθιας θωρακικής και οσφυϊκής περιοχής (Θ5 -Ο4) προκαλεί τοπικό συμπαθητικό αποκλεισμό με αγγειακή διαστολή στην περιοχή της πυέλου και των οπίσθιων άκρων. Οι αυτόνομες επιδράσεις είναι κλινικά σημαντικές εάν ο συμπαθητικός αποκλεισμός των γαγγλίων εκτείνεται μεταξύ του 5ου θωρακικού τρήματος (Θ5) και του 3ου οσφυϊκού τρήματος (Ο3). Ο συμπαθητικός και κινητικός αποκλεισμός μπορεί να αποφευχθεί όταν τα οπιοειδή, όπως η μορφίνη, χορηγούνται επισκληρίδια για την περιεγχειρητική αντιμετώπιση του πόνου. Οι αρνητικές καρδιαγγειακές επιδράσεις θα περιλαμβάνουν την αγγειοδιαστολή στα προσβεβλημένα δερμοτόμια με επακόλουθη υπόταση. Ο συμπαθητικός αποκλεισμός οδηγεί σε περιφερική αγγειοδιαστολή και μειωμένη καρδιακή φλεβική επιστροφή προκαλώντας υπόταση και βραδυαρρυθμίες, το λεγόμενο «αντίστροφο» αντανακλαστικό Bainbridge (Crystal & Salem 2012). Όταν ο αποκλεισμός εκτείνεται στο επίπεδο του 2ου θωρακικού τρήματος (Θ2) έως το 4ου θωρακικό τρήμα (Θ4), ο καρδιακός ρυθμός και η καρδιακή συσταλτικότητα ενδέχεται να μειωθούν λόγω αποκλεισμού των συμπαθητικών νευρικών ινών της καρδιάς (Jones 2001, Campoy 2004).
Μεταβολισμός και ορμόνες
Το χειρουργικό τραύμα προκαλεί φλεγμονή η οποία οδηγεί σε νευροενδοκρινική απόκριση που ενεργοποιεί το σύστημα ρενίνης-αγγειοτενσίνης και έχει ως αποτέλεσμα την αύξηση της συγκέντρωσης της αδρενοκορτικοτροπικής ορμόνης, της κορτιζόλης, της επινεφρίνης, της νορεπινεφρίνης και της αντιδιουρητικής ορμόνης στο αίμα. Αυτή η «απάντηση-στρες» μπορεί να κατασταλεί πλήρως ή μερικώς, με νευραξονικό αποκλεισμό (Almeida et al. 2010). Οι νευραξονικοί αποκλεισμοί μπορεί να μειώσουν τις περιεγχειρητικές αρρυθμίες, καταστέλλοντας την «απάντηση-στρες» και μειώνοντας την απελευθέρωση επινεφρίνης και νορεπινεφρίνης (Campoy 2004). Η περιεγχειρητική αντίδραση-στρες συμβάλλει στη μετεγχειρητική ευαισθησία σε λοιμώξεις. Τα υψηλά επίπεδα κορτιζόλης και γλυκόζης στην κυκλοφορία που προκαλούνται από την αντίσταση στην ινσουλίνη μετά από χειρουργική διέγερση οδηγούν σε υψηλότερο κίνδυνο για μόλυνση του τραύματος και μειωμένη επούλωση του τραύματος. Η ολική καταστολή των επινεφριδικών και γλυκαιμικών αντιδράσεων μπορεί επίσης να έχει ευεργετική επίδραση στο ανοσοποιητικό σύστημα του ασθενούς και στη μετεγχειρητική ανάρρωση (Romano et al. 2016).
Τεχνική επισκληρίδιας αναισθησίας
Τοποθέτηση των ζώων
Η επισκληρίδιος αναισθησία μπορεί να διενεργηθεί στον κατεσταλμένο ή κατά προτίμηση αναισθητοποιημένο ασθενή σε στερνική ή πλάγια κατάκλιση. Η στερνική θέση είναι η προτιμώμενη, διότι προσφέρει καλύτερη απεικόνιση του επισκληρίδιου χώρου και, συνεπώς, υψηλότερο ποσοστό επιτυχίας λόγω της ευκολότερης αναγνώρισης του τελευταίου (Jones 2001, Martinez -Taboada and Redondo, 2017). Σε στερνική θέση, τα οπίσθια άκρα εκτείνονται κρανιακά με τη σπονδυλική στήλη λυγισμένη σε κυφωτική θέση που επιτρέπει τη μέγιστη έκταση και την ευκολότερη αναγνώριση του οσφυοϊερού χώρου (Jones 2001). Τα περισσότερα από τα εμπορικά διαθέσιμα διαλύματα, είναι υπότονα σε θερμοκρασία σώματος. Η ολική αραίωση των τοπικών αναισθητικών αυξάνει την υποτονικότητα τους, εκτός εάν προστεθεί γλυκόζη ή υπέρτονος φυσιολογικός ορός. Η επισκληρίδιος έγχυση υπότονων διαλυμάτων προκαλεί τη μετανάστευση των τοπικών αναισθητικών σε μη εξαρτώμενες περιοχές, ενώ η έγχυση υπέρτονων διαλυμάτων προκαλεί μόνο τη μετανάστευση των τοπικών αναισθητικών σε εξαρτημένες περιοχές. Ωστόσο, τα υπέρτονα διαλύματα σχετίζονται μερικές φορές με υψηλότερη συχνότητα νευροτοξικότητας (Ganem et al. 1996).
Ανατομικά ορόσημα για την οσφυοϊερή επισκληρίδιο αναισθησία
(Εικόνα 2) (Εικόνα 3) (Εικόνα 4)
Αφού τοποθετηθεί ο ασθενής είτε σε στερνική είτε σε πλάγια κατάκλιση, ανάλογα με την προτίμηση και την εμπειρία του κλινικού ιατρού, το τρίχωμα πρέπει να κουρευτεί επαρκώς ώστε να εντοπιστούν τα ανατομικά σημεία αναφοράς για την ακριβή εισαγωγή της βελόνας. Η στερνική θέση επιτρέπει την καλύτερη απεικόνιση της οσφυοϊεράς περιοχής και είναι προτιμότερη για την τεχνική της κρεμάμενης σταγόνας. Η πλάγια θέση μπορεί να ενδείκνυται σε περιπτώσεις τραυματισμού του ασθενούς στην περιοχή της πυέλου (κατάγματα της πυέλου κ.λπ.). Ο εντοπισμός της θέσης γίνεται με τη χρήση της οπίσθιας ραχιαίας λαγόνιας άκανθας της πυέλου και των ραχιαίων ακανθωδών αποφύσεων του Ο7 και των αντίστοιχων του ιερού οστού (Campoy 2004). Οι έξω λαγόνιες ακρολοφίες ψηλαφούνται με τον αντίχειρα και το μεσαίο δάκτυλο του ενός χεριού. Ο δείκτης του ίδιου χεριού κατευθύνεται ουραία και ψηλαφεί την ακανθώδη απόφυση του Ο7 (Wetmore & Glowaski 2000). Μια νοητή γραμμή που ενώνει τις οπίσθιες ραχιαίες λαγόνιες άκανθες διασχίζει τη μέση γραμμή στην οσφυοϊερή συμβολή που μπορεί να ψηλαφηθεί ως κοίλανση μεταξύ τους (Valverde 2008). Το κυρίαρχο χέρι πρέπει να τοποθετεί τη βελόνα με ακρίβεια στη μέση γραμμή και ουραία της ακανθώδους απόφυσης του Ο7, κάθετα στο επίπεδο της πυέλου (Jones 2001). Ο εντοπισμός των ανατομικών σημείων μπορεί να είναι δύσκολος σε σκύλους με έντονη μυϊκή μάζα ή παχύσαρκους σκύλους και σκύλους με στρογγυλεμένα οπίσθια μέρη. Σε αυτούς τους ασθενείς, η νοητή γραμμή ακολουθεί τη μέση γραμμή μεταξύ του Ο6 και του Ο7 και διασχίζει τη νοητή γραμμή που ενώνει τις λαγόνιες ακρολοφίες. Η ραχιαία ακανθώδης απόφυση του Ο7 ψηλαφάται και ο οσφυοϊερός χώρος προσδιορίζεται ως κοίλανση ακριβώς μπροστά από αυτήν (Jones 2001, Wetmore & Glowaski 2000).
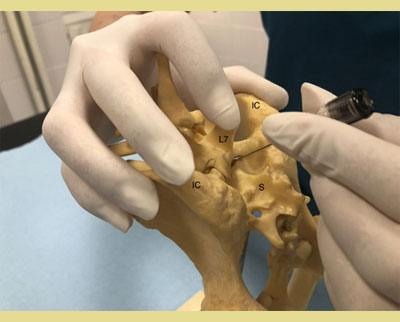
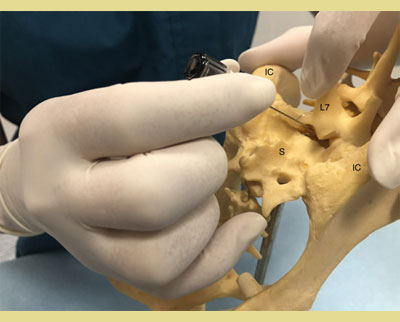
Εικόνα 2. και 3. Οι έξω λαγόνιες ακρολοφίες ψηλαφούνται με τον αντίχειρα και το μέσο δάκτυλο του ενός χεριού. Ο δείκτης του ίδιου χεριού ψηλαφεί την ακανθώδη απόφυση του έβδομου οσφυϊκού σπονδύλου (Ο7).
IC: Λαγόνιες Ακρολοφίες
L7: 7 Οσφυϊκός σπόνδυλος
S: Ιερό οστό
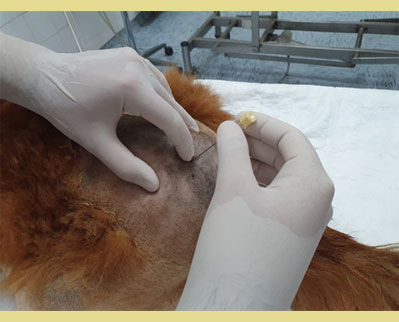
Εικόνα 4. Σε στερνική θέση, τα οπίσθια άκρα εκτείνονται κρανιακά με τη σπονδυλική στήλη λυγισμένη σε κυφωτική θέση. Οι έξω λαγόνιες ακρολοφίες ψηλαφούνται με τον αντίχειρα και το μεσαίο δάκτυλο του ενός χεριού. Ο δείκτης του ίδιου χεριού ψηλαφεί την ακανθώδη απόφυση του έβδομου οσφυϊκού σπονδύλου (Ο7). Η βελόνα εισάγεται κάθετα στο δέρμα.
Ειδικά στην ιεροκοκκυγική προσέγγιση, η γάτα τοποθετείται σε στερνική θέση με τα οπίσθια άκρα εκτεταμένα κρανιακά. Ο ιεροκοκκυγικός χώρος μπορεί να ψηλαφηθεί μεταξύ του ιερού οστού και του πρώτου κοκκυγικού σπονδύλου. Οι Torruella et al. (2023) ανέφεραν ότι η κίνηση της ουράς προς τα πάνω και προς τα κάτω μπορεί να είναι ευεργετική για τη σωστή αναγνώριση του επισκληριδίου χώρου. Η υπόλοιπη τεχνική είναι η ίδια με την προαναφερθείσα.
Ενδείξεις και αντενδείξεις
Η οσφυοϊερή και ιεροκοκκυγική ΕΑΑ θεωρείται ασφαλής και αποτελεσματική αναισθητική τεχνική σε διάφορες περιπτώσεις, όπως ορθοπεδικές επεμβάσεις, περιπρωκτικές και περιαιδοιικές επεμβάσεις και άλλες επεμβάσεις μαλακών μορίων ουραίως του ομφαλού, όπως η καισαρική τομή (Campoy 2004, Bartel et al. 2016) (Πίνακας 1).

Πίνακας 1.
Αντενδείξεις.
Η επισκληρίδιος αναισθησία έχει αρκετές αντενδείξεις. Οι διαταραχές της πήξης είναι μία από αυτές. Ο επισκληρίδιος χώρος έχει πολύ καλή αγγείωση και η ακούσια εισαγωγή της βελόνας σε κάποιο αγγείο θα οδηγούσε σε σχηματισμό επισκληριδίου ή ακόμη και υπαραχνοειδούς αιματώματος (εάν η βελόνα διαπεράσει τη σκληρή μήνιγγα) με αποτέλεσμα τη συμπίεση της σπονδυλικής στήλης και την επακόλουθη νευρολογική επιβάρυνση των οπίσθιων άκρων. Η υπογκαιμία και η βαθιά υπόταση αποτελούν επίσης σχετικές αντενδείξεις και ο επισκληρίδιος αποκλεισμός δεν πρέπει να διενεργείται πριν ο ασθενής σταθεροποιηθεί αιμοδυναμικά (Wetmore & Glowaski 2000).
Μια άλλη σημαντική αντένδειξη της επισκληρίδιας αναισθησίας είναι η παρουσία οποιουδήποτε τύπου λοιμώδους δερματικής νόσου, όπως πυόδερμα ή δερματίτιδα, στο σημείο της έγχυσης. Η εισαγωγή παθογόνων μικροοργανισμών στον επισκληρίδιο χώρο θα έχει πιθανότατα επιβλαβή επίδραση στις νευρικές δομές. Οι ασθενείς με νεοπλασία στην οσφυοϊερή περιοχή αποκλείονται επίσης από την επισκληρίδιο παρακέντηση, καθώς η εισαγωγή νεοπλασματικών κυττάρων θα είχε ανεπιθύμητες συνέπειες, όπως η διασπορά νεοπλασματικών κυττάρων στον επισκληρίδιο χώρο (Campoy 2004). Επιπλέον, αν και δεν έχει αποδειχθεί, η επισκληρίδιος χορήγηση αναισθητικών σε ασθενείς με σοβαρή βακτηριαιμία ή σηψαιμία μπορεί να προκαλέσει αιματογενή μετάδοση της λοίμωξης στον επισκληρίδιο ή σπονδυλικό χώρο σε περίπτωση ακούσιας τοποθέτησης βελόνας ή καθετήρα (Campoy 2004). Ωστόσο, αξίζει να αναφερθεί ότι στην ιατρική του ανθρώπου έχει πραγματοποιηθεί μία και μόνη επισκληρίδιος έγχυση σε περιπτώσεις σηψαιμίας και θεωρείται ωφέλιμη (Tyagi 2017).
Οι σχετικές αντενδείξεις της επισκληρίδιας αναισθησίας περιλαμβάνουν την απόφραξη του χώρου εξόδου της αριστερής κοιλίας, τις συγγενείς ανατομικές ανωμαλίες, το τραύμα της σπονδυλικής στήλης και τα νευρολογικά ελλείμματα (Wetmore & Glowaski 2000, Jones 2001). Οι ασθενείς με βαλβιδική αορτική στένωση, στένωση της μιτροειδούς ή υπερτροφική υποαορτική στένωση δεν έχουν την ικανότητα να αυξήσουν αποτελεσματικά την καρδιακή τους παροχή μετά από υπόταση συνεπεία επισκληρίδιας χορήγησης φαρμάκων και αυτή η περιορισμένη ανταπόκριση είναι επισφαλής. Παρ’ όλα αυτά, εάν οι ασθενείς αυτοί είναι ιατρικά καλά και δεν παρουσιάζουν καρδιακή ανεπάρκεια, θα μπορούσαν να ωφεληθούν από μια επισκληρίδιο αναισθησία (Jones 2001, Campoy 2004). Οι συγγενείς ανατομικές ανωμαλίες παρουσιάζουν τεχνικές δυσκολίες στην επισκληρίδιο αναισθησία λόγω της πιθανής αλλαγής των ανατομικών ορόσημων που μπορεί να καταστήσουν πιο περίπλοκη την εισαγωγή της βελόνας στον επισκληρίδιο χώρο, όπως ο μεταβατικός οσφυοϊερός σπόνδυλος. Σε αυτές τις ειδικές περιπτώσεις χρησιμοποιούνται πιο προηγμένες τεχνικές για την επιβεβαίωση του επισκληριδίου χώρου (Jones 2001). Τέλος, σε περιπτώσεις τραύματος της σπονδυλικής στήλης ή/και νευρολογικών ελλειμμάτων, η επισκληρίδιος έγχυση φαρμάκων αντενδείκνυται με σκοπό την αποφυγή περαιτέρω επιπλοκών (Wetmore & Glowaski 2000).
Μέθοδοι επιβεβαίωσης της τοποθέτησης της βελόνας στον επισκληρίδιο χώρο
Έχουν περιγραφεί διάφορες μέθοδοι για την επιβεβαίωση της σωστής τοποθέτησης της επισκληρίδιας βελόνας. Οι δύο πιο ευρέως χρησιμοποιούμενες μέθοδοι περιλαμβάνουν την «απώλεια αντίστασης» (LOR) και την τεχνική της κρεμάμενης σταγόνας. Κατά την «απώλεια αντίστασης», η βελόνα εισάγεται κάθετα στο δέρμα ή υπό γωνία 30-45° στις γάτες και προωθείται απαλά μέχρι να γίνει αισθητή μια αίσθηση «κριγμού», καθώς η βελόνα διαπερνά τον αρθρικό σύνδεσμο. Μετά την αφαίρεση του στυλεού και εφόσον δεν διαπιστωθεί αναρρόφηση εγκεφαλονωτιαίου υγρού (ΕΝΥ) ή αίματος στη σύριγγα, τοποθετείται στην βάση της βελόνας μια σύριγγα γεμάτη με φυσιολογικό ορό ή με αέρα και εγχέεται στον επισκληρίδιο χώρο μικρός όγκος (0,25-0,50 ml ανάλογα με το σωματικό βάρος του ασθενούς) αέρα ή φυσιολογικού ορού. Η επαλήθευση της σωστής τοποθέτησης της βελόνας είναι θετική όταν η έγχυση του αέρα ή του υγρού πραγματοποιείται χωρίς αντίσταση (Valverde 2008, O’Hearn & Wright 2011, Adami & Gendron 2017).
Στην τεχνική «κρεμάμενης σταγόνας», η βελόνα προωθείται ακριβώς κοντά αλλά όχι μέσα στον επισκληρίδιο χώρο και ο στυλεός απομακρύνεται πριν η βελόνα διαπεράσει τον ωχρό σύνδεσμο. Μια σταγόνα φυσιολογικού ορού ή τοπικού αναισθητικού τοποθετείται στη συνέχεια στην βάση της βελόνας και η βελόνα προωθείται μέσω του ωχρού συνδέσμου έως ότου η σταγόνα αναρροφηθεί στον επισκληρίδιο χώρο λόγω της αρνητικής πίεσης που υπάρχει στον επισκληρίδιο χώρο. Αυτό επιβεβαιώνει την ακριβή τοποθέτηση της βελόνας (Valverde 2008). Για ορισμένους συγγραφείς η τεχνική της «κρεμάμενης σταγόνας» είναι μια αρκετά αξιόπιστη τεχνική όταν ο ασθενής είναι τοποθετημένος σε στερνική θέση (Martinez -Taboada & Redondo, 2017) (Εικόνα 5) (Εικόνα 6).
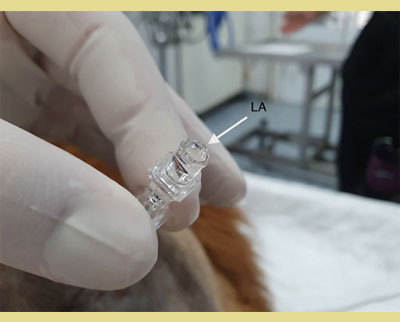
Εικόνα 5. Μια σταγόνα φυσιολογικού ορού ή τοπικού αναισθητικού τοποθετείται στην πλήμνη της βελόνας, μετά την αφαίρεση του στυλεού, και η βελόνα προωθείται μέσω του ωχρού συνδέσμου έως ότου η σταγόνα αναρροφηθεί στον επισκληρίδιο χώρο λόγω της αρνητικής πίεσης που υπάρχει στον επισκληρίδιο χώρο (τεχνική της κρεμάμενης σταγόνας). Αυτό επιβεβαιώνει την ακριβή τοποθέτηση της βελόνας.
LA: Ο μηνίσκος των τοπικών αναισθητικών
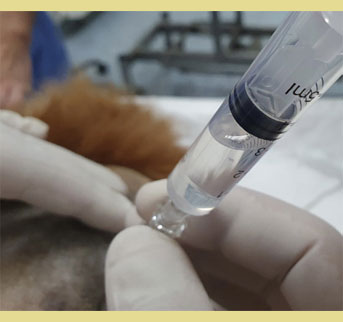
Εικόνα 6. Επαλήθευση της σωστής τοποθέτησης της βελόνας με την έγχυση αέρα ή υγρού χωρίς αντίσταση (Απώλεια Αντίστασης).
Υπάρχουν πιο εξελιγμένες μέθοδοι για την επαλήθευση της θέσης της βελόνας στην επισκληρίδιο αναισθησία. Μεταξύ αυτών είναι η χρήση νευροδιεγέρτη, η παρατήρηση των επισκληρίδιων κυμάτων πίεσης και η χρήση προηγμένων απεικονιστικών τεχνικών. Πραγματοποιείται με μια ηλεκτρικά μονωμένη σπονδυλική βελόνα που συνδέεται με μια κάθοδο νευροδιεγέρτη. Υπό βαθιά νάρκωση ή γενική αναισθησία, ο ασθενής τοποθετείται είτε σε πλάγια είτε σε στερνική θέση με τα οπίσθια άκρα εκτεταμένα προς τα εμπρός. Η άνοδος του νευροδιεγέρτη τοποθετείται στο δέρμα του ασθενούς πάνω από τον ημιτενοντώδη μυ του οπίσθιου άκρου. Η βελόνα συνδέεται με τον νευροδιεγέρτη και προωθείται απαλά πάνω από την οσφυοϊερή περιοχή. Η ηλεκτροδιέγερση βασίζεται στην αρχή ότι το ρεύμα που απαιτείται για την πρόκληση κινητικών αποκρίσεων μειώνεται καθώς η βελόνα εισάγεται στον επισκληρίδιο χώρο. Το ελάχιστο ηλεκτρικό κατώφλι (ΕΗΚ) για την πρόκληση μυϊκής συστολής των οπίσθιων άκρων και/ή εναλλαγών της ουράς όταν προσεγγίζεται ο επισκληρίδιος χώρος και διεγείρεται το επισκληρίδιο οσφυοϊερό πλέγμα είναι 0,3 mA στους σκύλους και 0,7mA στις γάτες, σε πλάτος παλμού 0,1ms. Αυτό θα επιβεβαιώσει τη σωστή τοποθέτηση της βελόνας στον επισκληρίδιο χώρο (Otero et al. 2015).
Η ανίχνευση των εξωμηνιγγικών κυμάτων πίεσης είναι μια άλλη πολλά υποσχόμενη τεχνική για την επαλήθευση της ακριβούς τοποθέτησης της βελόνας στον επισκληρίδιο χώρο. Πραγματοποιείται με έναν μετατροπέα πίεσης ο οποίος ανιχνεύει την παρουσία κυμάτων πίεσης μετά τη σωστή τοποθέτηση της βελόνας στον επισκληρίδιο χώρο (Adami & Gendron 2017). Μετά την εισαγωγή της σπονδυλικής βελόνας στον επισκληρίδιο χώρο, αυτή συνδέεται με έναν μετατροπέα πίεσης μέσω μιας γεμισμένης με υγρό, ανελαστικής γραμμής πίεσης και καταγράφονται οι τιμές της πίεσης. Αναμένεται αύξηση της πίεσης του εξωμηνιγγικού χώρου και ανιχνεύσιμα κύματα πίεσης μετά την εξωμηνιγγική χορήγηση συγκεκριμένης ποσότητας αποστειρωμένου φυσιολογικού ορού, επαληθεύοντας έτσι τη σωστή τοποθέτηση της βελόνας (Iff & Moens 2010). Τα επισκληρίδια κύματα πίεσης μοιάζουν με τις αρτηριακές κυματομορφές, οπότε όσο υψηλότερες είναι οι τιμές της πίεσης τόσο μεγαλύτερη είναι η δυνατότητα ανίχνευσής τους (Adami & Gendron 2017). Μια τελευταία αναβάθμιση αυτής της τεχνικής είναι ένα μόνιτορ συνεχούς πίεσης το οποίο εμφανίζει τις μετρήσεις πίεσης και παρέχει πληροφορίες σχετικά με το πάχος και τη διαμόρφωση του ιστού ή του χώρου όπου προωθείται η βελόνα. Κατά τη στιγμή που η σπονδυλική βελόνα εισάγεται στον επισκληρίδιο χώρο, ανιχνεύεται μια ξαφνική πτώση της πίεσης στο άκρο της βελόνας και αυτό μπορεί να απεικονιστεί στην οθόνη ή να μεταφραστεί σε ακουστικό σήμα (Sasauchi et al. 2016).
Η χρήση υπερήχων, αξονικής τομογραφίας με σκιαγραφικό, ακτινογραφίας και/ή ακτινοσκόπησης είναι πιο εξελιγμένες τεχνικές για την επαλήθευση της σωστής θέσης της βελόνας στον επισκληρίδιο χώρο. Η καθοδηγούμενη με υπερήχους τοποθέτηση της επισκληρίδιας βελόνας και του καθετήρα σε σκύλους είναι μια εφικτή μέθοδος που απαιτεί μόνο τη γνωριμία με τις ανατομικές δομές της οσφυοϊεράς περιοχής με υπερήχους σε παραοβελιαίες και εγκάρσιες εικόνες. Μπορεί να εκτελεστεί σε φυσιολογικούς ασθενείς, σε παχύσαρκους ασθενείς και σε ασθενείς με ακτινολογικές ανωμαλίες στον οσφυοϊερό χώρο. Η κατανομή του σκιαγραφικού μέσου μπορεί επίσης να χρησιμεύσει ως μέθοδος επιβεβαίωσης μέσω της αξονικής τομογραφίας ή της ακτινοσκόπησης. Επιπλέον, υπάρχουν δύο τεχνικές που αξίζει να αναφερθούν για την επιβεβαίωση του επισκληρίδιου χώρου, η τεχνική Baraka και η επισκληριδιογραφία. Παρά το γεγονός ότι ως τεχνική ο χρυσός κανόνας είναι η επισκληριδιογραφία, για τη μέση κλινική η τεχνική της κρεμάμενης σταγόνας είναι μια αποδεκτή εναλλακτική λύση για την επισκληρίδια αναισθησία και αναλγησία (Adami & Gendron 2017).
Βασικός εξοπλισμός για την επισκληρίδιο αναισθησία (Jones 2001)
- Κουρευτική μηχανή
- Διαλύματα χειρουργικής προετοιμασίας
- Βελόνα Tuohy (22-18-gauge) ή βελόνα σπονδυλικής στήλης (20-22-gauge, 2,5-7,5 cm)
- Βελόνα σπονδυλικής στήλης 22-21 gauge, 2,5 cm για μικρούς σκύλους και γάτες (Εικόνα 7)
- Βελόνα σπονδυλικής στήλης 20 gauge, 3,8 cm για σκύλους μεσαίου μεγέθους
- Βελόνα σπονδυλικής στήλης 18 gauge 7,5 cm για μεγάλους σκύλους
- Γυάλινη σύριγγα απώλειας αντίστασης
- Αποστειρωμένο ισότονο φυσιολογικό διάλυμα
- Διάλυμα τοπικού αναισθητικού χωρίς συντηρητικά με/χωρίς πρόσθετο
- Σύριγγες και βελόνες
- Αποστειρωμένα γάντια

Εικόνα 7.
Σπονδυλική βελόνα 22Ga
Ενέσιμος όγκος με βάση το σωματικό βάρος και το μήκος της σπονδυλικής στήλης
Υπάρχουν δύο μέθοδοι που χρησιμοποιούνται κυρίως για τον προσδιορισμό του όγκου των συνήθως χορηγούμενων φαρμάκων και συνδυασμών φαρμάκων στον επισκληρίδιο χώρο: το σωματικό βάρος και το μήκος της σπονδυλικής στήλης.
Βάρος σώματος
Ανάλογα με τον επιθυμητό αποκλεισμό και την επιλογή του φαρμάκου, οι δόσεις των τοπικών αναισθητικών προσαρμόζονται αναλόγως ώστε να αποκλεισθεί σημαντικός αριθμός νωτιαίων νεύρων. Η εξάπλωση των τοπικών αναισθητικών βασίζεται κυρίως στον όγκο που εγχέεται εντός του επισκληρίδιου χώρου. Συνηθίζεται η προσθήκη φυσιολογικού ορού 0,9% για να επιτευχθεί ο όγκος που απαιτείται για την εξασφάλιση της εξάπλωσης της επισκληρίδιας αναισθησίας και αναλγησίας προς τα εμπρός. Ο τυπικός τελικός όγκος για τα τοπικά αναισθητικά είναι συνήθως 0,2mL kg-1 με βάση το σωματικό βάρος. Για παράδειγμα, εάν ένας ασθενής ζυγίζει 20kg, ο τελικός όγκος που θα χορηγηθεί επισκληρίδια θα είναι 4ml με βάση το σωματικό βάρος. Ο όγκος αυτός εγχεόμενος στο Ο7 -Ι1 μεσοσπονδύλιο διάστημα μπορεί να επιτύχει αποκλεισμό μέχρι τη θωρακοοσφυϊκή περιοχή (Freire et al. 2010). Μικρότεροι όγκοι από 0,2mL kg -1 , οι οποίοι εκτείνονται έως τον Ο3 , επιτυγχάνουν αισθητικό αποκλεισμό της πυέλου και των πυελικών άκρων, ενώ μεγαλύτεροι όγκοι από 0,2mL kg-1 , οι οποίοι εκτείνονται έως τη θωρακοοσφυϊκή περιοχή, αποκλείουν την αισθητική νεύρωση της κοιλιάς (Valverde & Skelding 2019).
Μήκος σπονδυλικής στήλης
Το συνολικό μήκος της σπονδυλικής στήλης (Loc) υπολογίζεται από τον ινιακό κόνδυλο έως τον πρώτο κοκκυγικό σπόνδυλο. Όταν το μήκος της σπονδυλικής στήλης χρησιμοποιείται για τη μέτρηση του όγκου της επισκληρίδιας αναισθησίας, υπολογίζεται ως mLcm Loc -1 . Ένας όγκος 0,05 mLcm Loc -1 προσφέρει αποκλεισμό μέχρι το επίπεδο του Ο1 . Ένας όγκος 0,1 mL cm Loc-1 προσφέρει αποκλεισμό μέχρι το επίπεδο των Θ9 -Θ10 . Ένας όγκος 0,15 mL cm Loc-1 προσφέρει αποκλεισμό μέχρι το επίπεδο των Θ4 -Θ5 . Για παράδειγμα, εάν η ινιακή-κοκκυγική απόσταση ενός ασθενούς είναι 30 cm, ο τελικός όγκος που θα χορηγηθεί επισκληρίδια θα είναι 1,5 ml για να επιτευχθεί κρανιακός αποκλεισμός μέχρι το επίπεδο του Ο1 (Otero et al. 2010).
Οι υπολογιζόμενοι όγκοι με βάση το μήκος της σπονδυλικής στήλης σε σχέση με το σωματικό βάρος τείνουν να είναι υψηλότεροι στους μικρούς, μεσαίους και μεγάλους σκύλους με δείκτη σωματικής κατάστασης (BCS 2,3), ενώ στους μεγάλους (BCS 4,5) και τους γιγάντιους σκύλους η διαφορά δεν είναι κλινικά σημαντική. Παρ’ όλα αυτά, το BCS επηρεάζει σημαντικά τον επισκληρίδιο όγκο του ενέσιμου υλικού και πρέπει πάντα να λαμβάνεται υπόψη (Valverde & Skelding 2019). Δεδομένου ότι δεν υπάρχουν πολλά στοιχεία σχετικά με τη χρήση του μήκους της σπονδυλικής στήλης, οι συγγραφείς συμφωνούν ότι πρέπει να δοθεί προσοχή λαμβάνοντας υπόψη ότι η μέθοδος αυτή ακολουθείται από μεγαλύτερο όγκο σε μικρούς και μεσαίους σκύλους. Απαιτείται περαιτέρω έρευνα.
Συχνώς χορηγούμενα φάρμακα και συνδυασμοί φαρμάκων - Τοπικά αναισθητικά
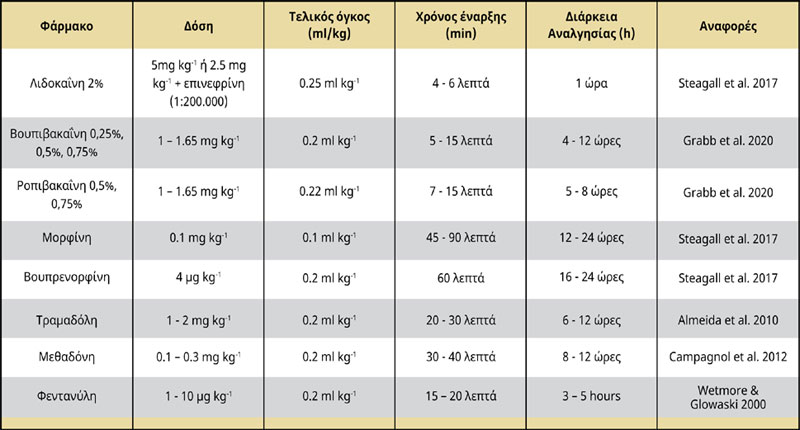
Ένας αριθμός τοπικών αναισθητικών διαφόρων συγκεντρώσεων, δόσεων και συνδυασμών έχει χρησιμοποιηθεί για την ανάπτυξη της επισκληρίδιας αναισθησίας, προκαλώντας ένα ευρύ φάσμα αισθητικών και κινητικών αποκλεισμών. Η λιδοκαΐνη 2% είναι ένα συχνά χρησιμοποιούμενο τοπικό αναισθητικό φάρμακο που μπορεί να χορηγηθεί επισκληρίδια και να προκαλέσει γρήγορη απευαισθητοποίηση με καλή χαλάρωση των μυών. Η τυπική δόση είναι 5mg/kg ή 2,5 mg kg-1 με την προσθήκη επινεφρίνης (1:200.000), μόνη της και σε συνδυασμό αντίστοιχα. Ο χρόνος έναρξης είναι 4 - 6 λεπτά και η διάρκεια δράσης διαρκεί 1 ώρα (Steagall et al. 2017).
Η βουπιβακαΐνη είναι το πιο κοινό τοπικό αναλγητικό που χρησιμοποιείται τόσο σε σκύλους όσο και σε γάτες για την πρόκληση μακράς διάρκειας ουραίας αναλγησίας (Ferreira et al. 2018). Η βουπιβακαΐνη μπορεί να βρεθεί ως ρακεμικό μείγμα 50:50 των εναντιομερών της, της δεξτροβουπιβακαΐνης και της λεβοβουπιβακαΐνης. Η λεβοβουπιβακαΐνη, ένα συνθετικό εναντιοκαθαρό διάλυμα, έχει παρόμοια διάρκεια δράσης και δοσοεξαρτώμενο βαθμό αναλγησίας και κινητικού αποκλεισμού σε σύγκριση με την παραδοσιακή ρακεμική βουπιβακαΐνη (Cerasoli et al. 2017). Η λεβοβουπιβακαΐνη προκαλεί επίσης λιγότερες αρρυθμίες και καρδιοτοξικότητα από αντίστοιχες συγκεντρώσεις βουπιβακαΐνης (Groban et al. 2001). Δεν υπάρχει συμφωνία μεταξύ των αναφορών σχετικά με τις δόσεις, τις συγκεντρώσεις και τους όγκους της βουπιβακαΐνης (Freire et al. 2010) Μια επισκληρίδιος έγχυση 0,25 % ή 0,75 % βουπιβακαΐνης (0,5 - 1 mg kg-1 ) προκαλεί αισθητικό αποκλεισμό μέχρι το επίπεδο του Ο3 ή του Ο4, αντίστοιχα (Duke et al. 2000). Ο χρόνος έναρξης είναι 5-15 λεπτά και η διάρκεια δράσης είναι 4-12 ώρες (Campoy et al 2013, Steagall et al. 2017, Grubb & Lobprise 2020).
Η ροπιβακαΐνη είναι ένα τοπικό αναλγητικό αμινοαμιδίου νέας γενιάς, μορφολογικά παρόμοιο με τη βουπιβακαΐνη. Παρά τη χαμηλότερη λιποδιαλυτότητα της ροπιβακαΐνης, φαίνεται να είναι πιο αποτελεσματική στον αποκλεισμό των ινών Αδ και C (Duke et al. 2000). Η λιγότερο καρδιοτοξική και αρρυθμιογόνος ροπιβακαΐνη παρέχει ενισχυμένη περιεγχειρητική αναλγησία με επαρκή αποκλεισμό της αισθητικής λειτουργίας, όταν χορηγείται σε επισκληρίδιο μείγμα με οπιοειδή (Groban et al. 2001, Bosmans και συν. 2012). Η επισκληρίδιος ροπιβακαΐνη 0,75 % μόνη της με τη χρήση 1,65 mg kg-1 μπορεί επίσης να παρέχει επιτυχή αισθητικό αποκλεισμό στα δερμοτόμια Ο5 - Ο7 (Duke et al. 2000), ενώ παράγει κινητικό αποκλεισμό μικρότερης διάρκειας. Ο χρόνος έναρξης είναι 7-15 λεπτά και η διάρκεια δράσης είναι 5 - 8 ώρες (Campoy et al. 2013, Steagall et al. 2017, Grubb & Loprsie 2020).
Οπιοειδή
Η επισκληρίδιος χορήγηση οπιοειδών παρέχει αξιόλογη προληπτική αναλγησία, ενώ ελαχιστοποιεί τον κίνδυνο ανεπιθύμητων ενεργειών που συνδέονται με τη συστηματική χορήγηση των ίδιων φαρμάκων (Troncyet al. 2002). Η μορφίνη, ένα οπιοειδές χωρίς συντηρητικά, με χαμηλή λιποδιαλυτότητα, προκαλεί μεγαλύτερης έντασης και διάρκεια δράσης επισκληρίδια αναλγησία (Wetmore & Glowaski 2000, Valverde 2008). Η επισκληρίδιος έγχυση μορφίνης σε δόση 0,1 mg kg-1 με χρήση 0,1 ml kg-1 θα μπορούσε επίσης να συνδυαστεί με τοπικά αναισθητικά παρέχοντας καλύτερης ποιότητας αναλγησία και επαρκή έλεγχο του πόνου. Η επισκληρίδιος έγχυση μορφίνης χωρίς συντηρητικά μπορεί να χορηγηθεί μόνη της σε περιπτώσεις όπου πρέπει να αποφευχθεί ο κινητικός και συμπαθητικός αποκλεισμός. Ο χρόνος έναρξης είναι 45 - 90 λεπτά και η διάρκεια δράσης διαρκεί από 12 έως 24 ώρες (Kona - Boun et al. 2006, Steagall et al. 2017). Παρόλο που τα οπιοειδή δεν προκαλούν συμπαθητικό ή κινητικό αποκλεισμό, η χορήγηση μορφίνης μπορεί να έχει ορισμένες παρενέργειες, όπως έμετο, ήπια καρδιαγγειακή και αναπνευστική καταστολή, κνησμό, καθυστερημένη έκφυση τριχώματος και κατακράτηση ούρων (Troncy et al. 2002).
Η υδροχλωρική οξυμορφίνη είναι ένα άλλο οπιοειδές χωρίς συντηρητικά, το οποίο είναι περισσότερο λιποδιαλυτό και 10 φορές πιο ισχυρό επισκληρίδια από τη μορφίνη. Χορηγείται σε 0,1 mg kg-1 σε συνδυασμό με 0,75% βουπιβακαΐνη 1 mg kg-1 σε τελικό όγκο 0,2 ml kg-1 που εγχύεται στον οσφυοϊερό χώρο. Ο χρόνος έναρξης της δράσης οξυμορφόνης είναι 20 - 40 λεπτά και η διάρκεια δράσης είναι από 6 έως 10 ώρες (Steagall et al. 2017). Δεδομένου ότι η οξυμορφόνη προκαλεί μια κεντρικά διαμεσολαβούμενη αύξηση του πνευμονογαστρικού τόνου, είναι μάλλον αναμενόμενη η μείωση του καρδιακού ρυθμού, η παροδική υπόταση και η ενδεχόμενη αναπνευστική καταστολή. Η οξυμορφόνη μπορεί να προκαλέσει βαθύτερη τμηματική επίδραση σε σύγκριση με τη μορφίνη λόγω της ενδιάμεσης λιποδιαλυτότητας και της συνακόλουθης ταχείας συστηματικής απορρόφησης μετά από επισκληρίδιο έγχυση. Ως εκ τούτου, η επισκληρίδιος χορήγησή της είναι προτιμότερη για χειρουργικές επεμβάσεις που αφορούν τα οπίσθια άκρα και την ουραία κοιλιακή χώρα (Torske et al. 1999). Η οξυμορφόνη παραμένει ένα από τα πιο ακριβά οπιοειδή στην κτηνιατρική κλινική πρακτική. Ωστόσο, υπάρχουν οικονομικότερες εναλλακτικές λύσεις στη χρήση της οξυμορφόνης, όπως η υδρομορφόνη, η δράση της οποίας βρίσκεται μεταξύ μορφίνης και οξυμορφόνης (Pettifer & Dyson 2000).
Η μεθαδόνη είναι ένα άλλο οπιοειδές αναλγητικό του οποίου η επισκληρίδιος χορήγηση προκαλεί πιο βαθιά και παρατεταμένη αναλγησία από την παρεντερική χορήγησή του (Campagnol et al. 2012). Η μεθαδόνη μέσω της επισκληρίδιας οδού αμβλύνει την αλγαισθησία χωρίς κινητικές επιδράσεις και μπορεί να επιτρέψει τη μείωση των απαιτήσεων σε εισπνεόμενο αναισθητικό για χειρουργικές επεμβάσεις όπου λαμβάνει χώρα παρατεταμένη τραυματική διέγερση (Campagnol et al. 2012). Η επισκληρίδιος έγχυση της μεθαδόνης σε δόση 0-0,5 mg kg-1 έχει έναρξη δράσης 10 έως 20 λεπτά και η διάρκεια της αναλγησίας της διαρκεί έως και 7 ώρες (Bosmans et al. 2012). Αν και οι καρδιοαναπνευστικές και ηρεμιστικές επιδράσεις της ενδοφλέβια ή επισκληρίδια χορηγούμενης μεθαδόνης είναι παρόμοιες, η επισκληρίδιος οδός παρέχει αναλγητική δράση μεγαλύτερης διάρκειας με επίκεντρο συγκεκριμένα δερμοτόμια (Campagnol et al. 2012).
Η φεντανύλη είναι ένα οπιοειδές που χρησιμοποιείται συχνά στην ανθρώπινη ιατρική, το οποίο μπορεί να προστεθεί σε συνδυασμό με άλλα τοπικά αναισθητικά, όμως λόγω της υψηλής λιποφιλικότητάς του παρέχει μικρή διάρκεια δράσης (Saritas et al. 2014, Steagall et al. 2017).
Η βουτορφανόλη και η βουπρενορφίνη είναι οπιοειδή με υψηλή λιποδιαλυτότητα που προκαλούν κυρίως τμηματική νωτιαία αναλγησία. Η βουτορφανόλη σε δόση 0,25 mg kg-1 θα μπορούσε να επιλεγεί για επισκληρίδιο χορήγηση λόγω της έλλειψης καρδιαγγειακών παρενεργειών. Ο χρόνος έναρξής της είναι 10 έως 20 λεπτά και η διάρκεια της δράσης της διαρκεί από 3 έως 4 ώρες. Η βουπρενορφίνη στη δόση των 4μg kg-1 είναι μια πολλά υποσχόμενη εναλλακτική λύση της επισκληρίδιας μορφίνης με την ίδια αναλγητική δράση και διάρκεια δράσης (Smith & Kwand 2001, Towers 2020). Ο χρόνος έναρξης της δράσης της είναι μικρότερος από 45 - 60 λεπτά και η διάρκεια δράσης της διαρκεί έως και περισσότερο από 24 ώρες. Η επισκληρίδιος χορήγηση βουπρενορφίνης προκα- λεί μακροχρόνια αναλγησία με χαμηλή πιθανότητα κατακράτησης ούρων και επαρκή ανταλγαισθητική δράση (Steagall et al. 2017, Towers 2020). Με βάση την έννοια της πολυτροπικής αναλγησίας, η βουπρενορφίνη μπορεί να χρησιμοποιηθεί σε συνδυασμό είτε με βουπιβακαΐνη είτε με α2 αδρενεργικούς παράγοντες, όπως η μεδετομιδίνη, αναπτύσσοντας τη συνέργεια τοπικών αναισθητικών και οπιοειδών που παρέχει ταχεία έναρξη και ενι- σχυμένη αναλγησία (Steagall et al. 2009, Bartel et al. 2016, Towers 2020).
Οι α-2 αδρενεργικοί αγωνιστές, όπως η μεδετομιδίνη και η δεξμεδετομιδίνη, είναι γνωστοί για τις ανταλγαισθητικές τους ιδιότητες και τη συνεργική τους αλληλεπίδραση με τα οπιοειδή στο νωτιαίο μυελό. Παρά την εξέχουσα καταστολή της καρδιαγγειακής λειτουργίας που προκαλούν οι α2 - αδρενεργικοί αγωνιστές και την αναπνευστική καταστολή που προκαλούν τα οπιοειδή, ο επισκληρίδιος συνδυασμός τους παρέχει μεγαλύτερη διάρκεια αναλγησίας με λιγότερες παρενέργειες, καθώς απαιτούνται χαμηλότερες δόσεις για να παραχθεί ο επιθυμητός αποκλεισμός (Branson et al. 1993). Η μεδετομιδίνη σε δόση 10μg kg-1 σε συνδυασμό με μορφίνη σε δόση 0,11 mg kg-1 μπορεί να προσφέρει αναλγησία έως και 13 ώρες (Branson et al. 1993). Η δεξμεδετομιδίνη, το ενεργό εναντιομερές του ρακεμικού μείγματος μεδετομιδίνης, παρατείνει ομοίως τη διάρκεια και ενισχύει τη δράση των τοπικών αναισθητικών μέσω των α-2Α αδρενοϋποδοχέων με ελάχιστη επίδραση στην κινητική λειτουργία (Yoshitomi et al. 2008). Η επισκληρίδιος χορήγηση δεξμεδετομιδίνης σε δόση 3 - 6 μg kg-1 συμβάλλει στη μείωση της MAC του ισοφλουρανίου με δοσοεξαρτώμενο τρόπο, η οποία μπορεί να διαρκέσει έως και 4,5 ώρες. Ωστόσο, η δεξμεδετομιδίνη μπορεί να προκαλέσει βραδυκαρδία ή/και αύξηση της αρτηριακής πίεσης (Campagnol et al. 2007).
Η κεταμίνη είναι ένας μη ανταγωνιστικός ανταγωνιστής του υποδοχέα Ν-μεθυλο-D-ασπαρτικού και μειώνει την υπερδιέγερση του νωτιαίου μυελού και την αλγαισθησία. Βρίσκεται στο εμπόριο ως ρακεμικό μείγμα δύο εναντιομερών, της S(+) κεταμίνης και της R(-) κεταμίνης. Η S(+) κεταμίνη είναι το αριστερόστροφο οπτικό ισομερές και η R(-) κεταμίνη είναι το δεξιόστροφο οπτικό ισομερές. Η S(+) κεταμίνη έχει 4 φορές μεγαλύτερη συγγένεια για τους υποδοχείς Ν-μεθυλο-D-ασπαρτικού από την R(-) κεταμίνη. Η επισκληρίδιος χορήγηση κεταμίνης σε ρακεμικό μείγμα ή μόνο της S(+) κεταμίνης σε δόσεις 1 - 3 mg kg-1 μπορεί να χρησιμοποιηθεί προληπτικά σε συνδυασμό με οπιοειδή ή άλλα τοπικά αναισθητικά για τη θεραπεία της υπεραλγησίας που ακολουθεί την χειρουργική τομή. Παρόλο που το ισομερές S(+) είναι 2-4 φορές πιο ισχυρό από τη ρακεμική μορφή, το τελευταίο έχει βαθύτερη αναλγητική δράση με παρατεταμένη περίοδο αποκατάστασης (Duque et al. 2004). Η προληπτική έγχυση κεταμίνης μπορεί να προσφέρει κινητικό, αισθητικό και συμπαθητικό αποκλεισμό με ελάχιστες αιμοδυναμικές επιδράσεις και καρδιοαναπνευστική καταστολή. Επιπλέον, η κεταμίνη μετά από επισκληρίδιο ένεση μπορεί να προκαλέσει σιαλόρροια, νυσταγμό, συνειδητό έλλειμμα ιδιοδεκτικότητας, αταξία και κατάκλιση μικρότερης διάρκειας από την περίοδο της αναλγησίας (DeRossi et al. 2009).
Η τραμαδόλη είναι ένα ρακεμικό μείγμα δύο εναντιομερών [(+) και (-)], του οποίου η αναλγητική δράση προκύπτει κυρίως από τη δράση του εναντιομερούς Μ1. Η επισκληρίδιος χορήγηση τραμαδόλης σε δόση 1 - 2 mg kg-1 σε συνδυασμό με τοπικά αναισθητικά παράγει επαρκή ενδοκαι μετεγχειρητική αναλγησία για 6 έως 12 ώρες (Almeida et al. 2010). Η επισκληρίδιος τραμαδόλη δεν ενέχει κίνδυνο αναπνευστικής καταστολής σε σύγκριση με άλλα οπιοειδή, όπως η μορφίνη, τα οποία μπορεί να προκαλέσουν ήπια καρδιοαναπνευστική καταστολή Υπάρχουν ενδείξεις ότι δεν υπάρχει σημαντική διαφορά μεταξύ της συστηματικής έναντι της επισκληρίδιας χορήγησης της τραμαδόλης (Mastrocinque et al. 2012) (Πίνακας 2).
Πίνακας 2 Σχηματική απεικόνιση του επισκληρίδιου χώρου Αστέρι: Το άκρο της βελόνας φαίνεται στον επισκληρίδιο χώρο.
Ανεπιθύμητες ενέργειες
Οι ανεπιθύμητες ενέργειες που σχετίζονται με την επισκληρίδιο αναισθησία είναι σπάνιες όταν οι προϋπάρχουσες αντενδείξεις εντοπίζονται εγκαίρως. Οι περισσότερες επιπλοκές υποχωρούν γρήγορα μετά τη διακοπή της φαρμακευτικής δράσης με ελάχιστες πρόσθετες παρεμβάσεις (Wetmore & Glowaski 2000).
Η πιο συχνή επιπλοκή είναι ο υποαερισμός που οφείλεται σε αναπνευστική καταστολή λόγω του αποκλεισμού του φρενικού νεύρου. Η αναπνευστική παράλυση έχει μεγαλύτερη συχνότητα στους παχύσαρκους ασθενείς λόγω της περίσσειας επισκληριδίου λίπους και του περιορισμένου επισκληριδίου χώρου. Ο γρήγορος ρυθμός χορήγησης και η θέση του ασθενούς με το κεφάλι προς τα κάτω ευθύνονται συχνά για την κρανιακή μετανάστευση του τοπικού αναισθητικού σε πιο απομακρυσμένα νευροτόμια (Savvas et al. 2016). Η ακούσια χορήγηση τοπικών αναισθητικών στον υπαραχνοειδή χώρο μπορεί επίσης να προκαλέσει αναπνευστική καταστολή που αποδίδεται στην πρόσθια διασπορά του φαρμάκου μέσω του εγκεφαλονωτιαίου υγρού. Έτσι, οι συνήθεις επισκληρίδιες δόσεις των τοπικών αναισθητικών θα πρέπει να μειώνονται στο μισό εάν η βελόνα τοποθετηθεί στον υπαραχνοειδή χώρο (Jones 2001). Εάν εμφανιστεί αναπνευστική καταστολή λόγω τοπικών αναισθητικών ή επισκληρίδιας μορφίνης, θα πρέπει να αντιμετωπίζεται με υποβοηθούμενο αερισμό και χαμηλή δόση ναλοξόνης (0,005-0,02 mg kg-1 iv) ή ναλβουφίνης (0,03-0,1 mg kg-1 ) για να μεταβληθούν οι συστηματικές επιδράσεις αντίστοιχα (Wetmore & Glowaski 2000).
Η καρδιαγγειακή καταστολή που οφείλεται στον αποκλεισμό των συμπαθητικών ινών ή στην προς τα εμπρός εξάπλωση του τοπικού αναισθητικού στα τέσσερα ανώτερα θωρακικά δερμοσώματα είναι μια άλλη ανεπιθύμητη ενέργεια. Ο συνολικός όγκος των τοπικών αναισθητικών που εγχέονται επισκληρίδια πρέπει να εκτιμάται προσεκτικά και να αποφεύγεται η χρήση όγκων που υπερβαίνουν τα 0,2 ml kg-1 ( Bosmans et al. 2011). Η μετα-επισκληρίδιος βραδυκαρδία και η υπόταση που οδηγούν σε μειωμένη φλεβική επιστροφή, χαμηλή καρδιακή παροχή και συστηματική αγγειακή αντίσταση ως αποτέλεσμα του εκτεταμένου συμπαθητικού αποκλεισμού μπορεί να είναι οι προκαταρκτικές αιτίες καρδιακής ανακοπής, ιδίως σε ασθενείς με μη θεραπευμένη υποογκαιμία. Η υπόταση μπορεί να αντιμετωπιστεί με την αύξηση της χορήγησης κρυσταλλοειδών υγρών και τη μείωση των συγκεντρώσεων του εισπνευστικού αναισθητικού, εάν βρίσκονται υπό γενική αναισθησία. Η θεραπεία μπορεί να περιλαμβάνει τη χορήγηση αγγειοσυσπαστικών παραγόντων, όπως εφεδρίνη (0,05 mg kg-1 iv bolus) ή ντοπαμίνη (5-10 μg kg-1 CRI) ή αντιχολινεργικών παραγόντων, όπως ατροπίνη (0,02-0,04 mg kg-1 iv), εάν είναι εμφανής η υπόταση που προκαλείται από βραδυκαρδία (Savvas et al. 2006, Steagall et al. 2017). Αποτελεί κοινή πεποίθηση ότι η υπόταση μπορεί να προληφθεί με την προφόρτιση με κρυσταλλοειδές διάλυμα (Wetmore & Glowaski 2000, Jones 2001). Η υπόταση μπορεί επίσης να αντιμετωπιστεί με την ενδοφλέβια χορήγηση φαινυλεφρίνης, ενός ισχυρού αγωνιστή των α1 αδρενεργικών υποδοχέων με συνεχή ρυθμό έγχυσης 0,5 - 1 μg kg-1 min (Murphy et al. 2020, Cannarozzo et al. 2023).
Ο υψηλός συμπαθητικός αποκλεισμός μπορεί επίσης να οδηγήσει σε νευρολογικές επιπλοκές, όπως σύνδρομο Horner, αντανακλαστικά τύπου Shiff- Sherrington, μυϊκές συσπάσεις, σπασμούς και κώμα λόγω της τοξικότητας των τοπικών αναισθητικών στο κεντρικό νευρικό σύστημα (Jones 2001, Bosmans et al. 2011). Το σύνδρομο Horner μπορεί να προκληθεί όταν τα τοπικά αναισθητικά εξαπλώνονται σε περισσότερα κρανιακά νευροτόμια ή σε περίπτωση ακούσιας ενδορραχιαίας ή υποσκληρίδιας έγχυσης (Freire et al. 2010). Μυϊκές συσπάσεις στα οπίσθια άκρα και την ουρά και μυοκλονία μπορεί να εμφανιστούν μετά από επισκληρίδιο ή υπαραχνοειδή έγχυση οπιοειδών, ιδίως μορφίνης (Kona Boun et al. 2003). Η σοβαρότητα των σπασμών μπορεί να αντιμετωπιστεί μετά από επισκληρίδιο χορήγηση ναλοξόνης ή συστηματική χορήγηση οπιοειδών και ηρεμιστικών. Επιπλέον, η τοπική νευροτοξικότητα λόγω ακούσιας τοποθέτησης της βελόνας στο νωτιαίο μυελό ή σε μεγάλες νευρικές ρίζες στην ιππουρίδα μπορεί να οδηγήσει σε άμεση νευρική βλάβη προκαλώντας νευρικά ελλείμματα (Wetmore & Glowaski 2000).
Τα επισκληρίδια οπιοειδή είναι κυρίως υπεύθυνα για μια σειρά από παρενέργειες. Τόσο η επισκληρίδιος μορφίνη όσο και η υδρομορφόνη μπορεί να προκαλέσουν έμετο και ναυτία, οι οποίες μπορούν να αντιμετωπιστούν αποτελεσματικά με τη χρήση μαροπιτάντης (1mg kg-1 sc) (Troncy et al. 2002). Έχει επίσης παρατηρηθεί κνησμός μετά από επισκληρίδιο ή ενδορραχιαία έγχυση μορφίνης. Η χορήγηση ονδανσετρόνης, ναλοξόνης ή ακόμη και χαμηλών δόσεων προποφόλης μπορεί να αποτελέσει αποτελεσματική θεραπεία στον κνησμό που σχετίζεται με τα οπιοειδή (Troncy et al. 2012). Η κατακράτηση ούρων μπορεί να εμφανιστεί μετά τη χορήγηση οπιοειδών λόγω της χάλασης του εξωστήρα μυός που μπορεί να προκαλέσει αυξημένη χωρητικότητα και μειωμένη συσταλτικότητα της ουροδόχου κύστης (Kona Boun et al. 2003). Η κατακράτηση ούρων μπορεί να αντιμετωπιστεί με ήπια χειροκίνητη κένωση της ουροδόχου κύστης μετά τη χειρουργική επέμβαση και πριν από την αποσωλήνωση του ασθενούς. Αυτό θα μειώσει την ατονία του εξωστήρα μυός και τη δυσφορία που σχετίζεται με τη διάταση της ουροδόχου κύστης (Kona Boun et al. 2003). Η τοποθέτηση ουροκαθετήρα μπορεί να διευκολύνει τη συνεχή κένωση μέχρι να επανέλθει η φυσιολογική λειτουργία. Άλλες πιθανές επιπλοκές των επισκληρίδιων οπιοειδών, κυρίως όταν χορηγούνται από επισκληρίδιο καθετήρα, περιλαμβάνουν αλωπεκία ή καθυστέρηση στην έκφυση του τριχώματος (Valverde 2008). Οι επιπλοκές αυτές μπορούν επίσης να παρατηρηθούν και με την επισκληρίδιο χορήγηση τοπικών αναισθητικών (Guererro et al. 2014).
Συμπέρασμα
Η επισκληρίδιος αναισθησία και αναλγησία μπορεί να αποτελέσει μια σχετικά απλή αναλγητική τεχνική για μια ποικιλία χειρουργικών επεμβάσεων, όπως η καισαρική τομή, οι ορθοπεδικές επεμβάσεις στα οπίσθια άκρα και οι επεμβάσεις μαλακών μορίων ουραία του ομφαλού. Η επισκληρίδιος χορήγηση τοπικών αναισθητικών σε συνδυασμό με οπιοειδή μειώνει τις απαιτήσεις σε αναισθητικό και αναλγητικό και παρέχει αποτελεσματική αναλγησία με ελάχιστες παρενέργειες και καλή ποιότητα ανάρρωσης. Μετά από κατάλληλη εκπαίδευση, η επισκληρίδιος αναισθησία μπορεί να αποτελέσει μέρος ενός ισορροπημένου πρωτοκόλλου αναισθησίας που παρέχεται σε κτηνιατρικούς ασθενείς.
Σύγκρουση συμφερόντων
Οι συγγραφείς δεν δηλώνουν σύγκρουση συμφερόντων.
Υποσημειώσεις
a: Spinocan®, B. Braun Melsungen AG
Υπεύθυνη αλληλογραφίας:
Τσιτσιλιάνου Αλεξάνδρα
Αυτή η διεύθυνση ηλεκτρονικού ταχυδρομείου προστατεύεται από τους αυτοματισμούς αποστολέων ανεπιθύμητων μηνυμάτων. Χρειάζεται να ενεργοποιήσετε τη JavaScript για να μπορέσετε να τη δείτε.
Βιβλιογραφία
- Adami C, Gendron K (2017) What is the evidence? The issue of verifying correct needle position during epidural anaesthesia in dogs. Vet Anaesth Analg 44 (2), 212-218.
- Almeida RM, Escobar A, Maguilnik S (2010) Comparison of analgesia provided by lidocaine, lidocaine-morphine or lidocaine-tramadol delivered epidurally in dogs following orchiectomy. Vet Anaesth Analg 37 (6), 542-549.
- Bartel AK, Campoy L, Martin-Flores M, Gleed RD, Walker KJ, Scanapico CE, Reichard AB (2016) Comparison of bupivacaine and dexmedetomidine femoral and sciatic nerve blocks with bupivacaine and buprenorphine epidural injection for stifle arthroplasty in dogs. Vet Anaesth Analg 43 (4), 435-43.
- Bosmans T, Piron K, Oosterlinck M, Gasthuys F, Duchateau L, Waelbers T, Samoy Y, Van Vynckt D, Polis I (2012) Comparison of analgesic efficacy of epidural methadone or ropivacaine/methadone with or without pre-operative oral tepoxalin in dogs undergoing tuberositas tibiae advancement surgery. Vet Anaesth Analg 39 (6), 618-27.
- Bosmans T, Schauvliege S, Gasthuys F, Duchateau L, Marcilla MG, Gadeyne C, Polis I (2011) Cardiovascular effects of epidural administration of methadone, ropivacaine 0.75% and their combination in isoflurane anaesthetized dogs. Vet Anaesth Analg 38 (5), 494-504.
- Branson KR, Ko JC, Tranquilli WJ, Benson J & Thurmon JC (1993) Duration of analgesia induced by epidurally administered morphine and medetomidine in dogs. J Vet Pharmacol Ther 16 (3), 369-372.
- Campagnol D, Teixeira Neto FJ, Giordano T, Ferreira TH, Monteiro ER (2007) Effects of epidural administration of dexmedetomidine on the minimumalveolar concentration of isoflurane in dogs. Am J Vet Res 68 (12), 1308–18.
- Campagnol D, Teixeira-Neto J, Peccinini R G, Oliveira F A, Al- vaides R K, & Medeiros L Q (2012) Comparison of the effects of peridural or intravenous methadone on the minimum alveolar concentration of isoflurane in dogs. Vet J 192 (3), 311–315.
- Campoy L (2004) Epidural and spinal anaesthesia in the dog. In Pract 26 (5), 262-269. Campoy L & Read M R (2013) In: Small animal regional anesthesia and analgesia. John Wiley & Sons & Blackwell Publishing, Ames, Iowa, USA, p. 288.
- Cannarozzo C J, Araos J, Martin-Flores M (2023) Phenylephrine and norepinephrine increase blood pressure through opposing physiologic mechanisms in isoflurane-anesthetized dogs receiving acepromazine. Am J Vet Res 5, 1-7.
- Cerasoli I, Tutunaru A, Cenani A, Ramirez J, Detilleux J, Balligand M, Sandersen C (2017) Comparison of clinical effects of epidural levobupivacaine morphine versus bupivacaine morphine in dogs undergoing elective pelvic limb surgery. Vet Anaesth Analg 44 (2), 337-345.
- Crystal G J and Salem M R (2012) The Bainbridge and the “reverse” Bainbridge reflexes: history, physiology, and clinical relevance. Anesth Analg 114(3), 520-532.
- DeRossi R, Benites AP, Ferreira JZ, Neto JM, (2009) Hermeto LCEffects of lumbosacral epidural ketamine and lidocaine in xylazine-sedated cats. J S Afr Vet Assoc 80 (2), 79-83.
- Duke T, Caulkett NA, Ball SD, Remedios AM (2000) Comparative analgesic and cardiopulmonary effects of bupivacaine and ropivacaine in the epidural space of the conscious dog. Vet Anaesth Analg 27 (1), 13–21.
- Duque JC, Valadao CA, Farias A, De Almeida RM, Oleskovicz N (2004) Pre-emptive epidural ketamine or S (+) ketamine in post-incisional pain in dogs: a comparative study. Vet Surg 33 (4), 361–367.
- Ferreira JP (2018) Epidural anaesthesia–analgesia in the dog and cat: considerations, technique and complications. UK-Vet Comp Anim 23 (11), 628 – 636.i
- Cavalcanti RL, Noel-Morgan J (2010) Bupivacaine 0.25% and methylene blue spread with epidural anesthesia in dog. Ve Anaest Anal 37 (1), 63–69.
- Ganem EM, Vianna PT (1996) Marques M Neurotoxicity of subarachnoid hyperbaric bupivacaine in dogs. Reg Anaesth 21 (3), 234–238.
- Garcia – Pereira FL (2018) Epidural anesthesia and analgesia in small animal practice: An update. Vet J 242, 24 – 32.
- Gorgi AA, Hofmeister EH, Higginbotham MJ, Kent M (2006) Effect of body position on cranial migration of epidurally injected methylene blue in recumbent dogs. Am J Vet Res 67 (2), 219–21.
- Groban L, Deal DD, Vernon JC, James RL, Butterworth J (2001) Cardiac resuscitation after incremental overdosage with lidocaine, bupivacaine, levobupivacaine, and ropivacaine in anesthetized dogs. Anesth Analg 92(1), 37-43.
- Grubb T, Lobprise H (2020) Local and regional anaesthesia in dogs and cats: Overview of concepts and drugs (Part 1), Vet Med Sc 6 (2), 209–217.
- Kalchofner Guerrero KS, Guerrero TG, Schweizer-Kölliker M, Ringer SK, Hässig M, Bettschart-Wolfensberger R (2014) Incidence of delayed hair re-growth, pruritus, and urinary retention after epidural anaesthesia in dogs. Tierarztl Prax Ausg K Kleintiere Heimtiere 42 (2), 94 – 100.
- Iff I, Moens Y (2008) Two cases of bradyarrhythmia and hypotension after extradural injections in dogs. Vet Anaesth Analg 35 (3), 265-269.
- Iff I, Moens YP (2010) Evaluation of extradural pressure waves and the ‘lack of resistance’ test to confirm extradural needle placement in dogs. Vet J Sep 185 (3), 328–331.
- Jones R S (2001) Epidural analgesia in the dog and cat. Vet J 161(2), 123-131.
- Kamal M, Talaat, SM (2014) Comparative study of epidural morphine and epidural dexmedetomidine used as adjuvant to levobupivacaine in major abdominal surgery. Eg J Anaesth 30 (2), 137–141.
- Kona-Boun JJ, Cuvelliez S, Troncy E (2006) Evaluation of epidural administration of morphine or morphine and bupivacaine for postoperative analgesia after premedication with an opioid analgesic and orthopedic surgery in dogs. J Am Vet Med Assoc 229 (7), 1103-1112.
- Kona-Boun JJ, Pibarot P, Quesnel A (2003) Myoclonus and urinary retention following subarachnoid morphine injection in a dog. Vet Anaesth Analg 30 (4), 257-264.
- Martinez-Taboada F, Redondo JI (2017) Comparison of the hanging-drop technique and running-drip method for identifying the epidural space in dogs. Vet Anaesth Analg 44 (2), 329–336.
- Mastrocinque S, Almeida TF, Tatarunas AC, Imagawa VH, Otsuki DA, Matera JM, Fantoni DT (2012) Comparison of epidural and systemic tramadol for analgesia following ovariohysterectomy. J Am Anim Hosp Assoc 48 (5), 310 – 319.
- Murphy, KM, Rishniw, M, Silverstein, DC (2022) Use of vasopressors for treatment of vasodilatory hypotension in dogs and cats by Diplomates of the American College of Veterinary Emergency and Critical Care. J Vet Emerg Crit Care 32 (6), 714-722.
- O’Hearn AK, Wright BD (2011) Coccygeal epidural with local anesthetic for catheterization and pain management in the treatment of feline urethral obstruction. J Vet Emerg Crit Care 21 (1), 50–52.
- Otero P, Tarragona L, Ceballos M, Portela D (2010) Epidural cephalic spread of a local anesthetic in dogs: a mathematical model using the column length. Vet Anaesth Analg 37. In: Proceedings of the 10th World Congress of Veterinary Anaesthesia 2009 Glasgow, Scotland, p. 35.
- Otero PE, Verdier N, Zaccagnini AS, Fuensalida SE, Tarragona L, Portela DA (2015) The use of a nerve stimulation test to confirm sacrococcygeal epidural needle placement in cats. Vet Anaesth Analg 42 (1), 115–118.
- Pettifer G, Dyson D (2000) Hydromorphone: a cost-effective alternative to the use of oxymorphone. Can Vet J 41(2), 135-137.
- Romano M, Portela DA, Breghi G, Otero PE (2016) Stress-related biomarkers in dogs administered regional anesthesia or fentanyl for analgesia during stifle surgery. Vet Anaesth Analg 43 (1), 44–54.
- Saritas ZK, Saritas TB, Pamuk K, Korkmaz M, Demirkan I, Yaprakci MV, Sivaci RG (2014) Comparison of the effects of lidocaine and fentanyl in epidural anesthesia in dogs. Bratisl Lek Listy 115 (8), 508-13.
- Sasauchi K, Sunada K, Nakamura T (2023) Long-Term Evaluation of Continuous Epidural Anesthesia in an Improved Canine Model. Anesth Pain Med 6 (4), e35458.
- Savvas I, Anagnostou T, Papazoglou LG, Raptopoulos D (2006) Successful resuscitation from cardiac arrest associated with extradural lidocaine in a dog. Vet Anaesth Analg 33 (3), 175-178.
- Smith LJ, Yu JK (2001) A comparison of epidural buprenorphine with epidural morphine for postoperative analgesia following stifle surgery in dogs. Vet Anaesth Analg 28 (2), 87-96.
- Steagall PV, Millette V, Mantovani FB, Gilbert P, Luna SP, Duke-Novakovski T (2009) Antinociceptive effects of epidural buprenorphine or medetomidine, or the combination, in conscious cats. J Vet Pharmacol Ther 32(5), 477-484.
- Steagall PVM, Simon BT, Teixeira Neto FJ, Luna SPL (2017) An update on drugs used for lumbosacral epidural anesthesia and analgesia in dogs. Front Vet Sci 12 (4), 68.
- Torske KE, Dyson DH, Conlon PD (1999) Cardiovascular effects of epidurally administered oxymorphone and an oxymorphonebupivacaine combination in halothane-anesthetized dogs. Am J Vet Res 60, 194-200.
- Torruella X, Potter J, Huuskonen V (2023) Sacrococcygeal epidural administration of 0.5% bupivacaine in seven cats undergoing pelvic or hind limb orthopaedic procedures. Ir Vet J 76 (1), 1.
- Towers T (2020) Comparison of epidural morphine and buprenorphine for hindlimb orthopedic surgery in dogs. Veterinary Evidence 5(2).
- Troncy E, Junot S, Keroack S, Sammut V, Pibarot P, Genevois JP, Cuvelliez S (2002) Results of preemptive epidural administration of morphine with or without bupivacaine in dogs and cats undergoing surgery: 265 cases (1997–1999). J Am Vet Med Assoc 221 (5), 666–672.
- Tyagi A (2017) Thoracic epidural block in sepsis: looking beyond the known. J Anaesthesiol Clin Pharmacol 33 (2), 148-150.
- Valverde A, Skelding A (2019) Comparison of calculated lumbosacral epidural volumes of injectate using a dose regimen based on body weight versus length of the vertebral column in dogs. Vet Anaesth Analg 46 (1), 135-140.
- Valverde A (2008) Epidural analgesia and anesthesia in dogs and cats. Vet Clin North Am Small Anim Pract 38(6), 1205-1230.
- Wetmore LA, Glowaski MM (2000) Epidural analgesia in veterinary critical care. Clin Tech Small Anim Pract 15 (3), 177–188.
- Yoshitomi T, Kohjitani A, Maeda S, Higuchi H, Shimada M, Miyawaki T (2008) Dexmedetomidine enhances the local anesthetic action of lidocaine via an alpha-2A adrenoceptor. Anesth Analg 107 (1), 96-101.



